BSCKII. Lê Tự Định -
Dịch tễ học bệnh đái tháo đường và bệnh thận mạn
Bệnh thận mạn (CKD = Chronic Kidney Disease) được chẩn đoán khi sự gia tăng liên tục của albumin trong nước tiểu (albumin niệu), mức lọc cầu thận ước tính (eGFR) thấp, hoặc các biểu hiện tổn thương thận khác. Bệnh thận do đái tháo đường (Bệnh thận đái tháo đường, DKD = Diabetic Kidney Disease ), xảy ra ở 20–40% bệnh nhân đái tháo đường (ĐTĐ). DKD thường phát triển sau thời gian mắc ĐTĐ típ 1 khoảng 10 năm nhưng có thể xuất hiện ngay tại thời điểm được chẩn đoán với các bệnh nhân ĐTĐ típ 2. CKD có thể tiến triển thành bệnh thận giai đoạn cuối (ESRD) cần lọc máu hoặc ghép thận và là nguyên nhân hàng đầu của ESRD ở Hoa Kỳ. Ngoài ra, sự hiện diện của bệnh thận mạn ở bệnh nhân ĐTĐ típ 1 và típ 2, làm tăng đáng kể nguy cơ tim mạch và chi phí chăm sóc y tế
Đánh giá Albumin niệu và mức lọc cầu thận ước tính (eGFR)
Sàng lọc albumin niệu có thể được thực hiện dễ dàng nhất bằng cách tính tỷ lệ albumin/creatinine niệu (UACR) khi xét nghiệm nước tiểu ngẫu nhiên, hoặc lấy nước tiểu trong 24 giờ (độ chính xác cao hơn). Đo albumin niệu đơn thuần (dù bằng xét nghiệm miễn dịch hoặc bằng cách sử dụng que thử) mà không đo đồng thời creatinin (Cr) nước tiểu thì ít tốn kém hơn nhưng dễ bị xác định âm tính giả và dương tính giả do kết quả của sự thay đổi nồng độ nước tiểu do quá trình hydrat hóa. Do đó, để hữu ích cho việc sàng lọc bệnh nhân, các xét nghiệm sàng lọc bán định tính hoặc định tính (que thử) phải dương tính > 85% ở những người có albumin niệu tăng vừa phải (≥30 mg/g) và được xác nhận bằng tỷ UACR. Do đó, tốt hơn là chỉ cần lấy mẫu nước tiểu tại chỗ để biết tỷ UACR.

UACR bình thường được định nghĩa là <30 mg/g Cr, và albumin niệu cao được xác định là ≥30 mg/g Cr. Tuy nhiên, UACR là một phép đo liên tục, và sự khác biệt trong phạm vi bình thường và bất thường có liên quan đến kết cục thận và tim mạch. Hơn nữa, do sự khác biệt sinh học cao > 20% giữa các lần đo về albumin niệu, hai trong số ba mẫu UACR được thu thập trong khoảng thời gian từ 3 đến 6 tháng sẽ là bất thường trước khi xem xét một bệnh nhân có albumin niệu cao hoặc rất cao. Tập thể dục trong vòng 24 giờ, nhiễm trùng, sốt, suy tim sung huyết, tăng đường huyết rõ rệt, kinh nguyệt và tăng huyết áp rõ rệt có thể làm tăng UACR độc lập với tổn thương thận.
eGFR nên được tính từ creatinine huyết thanh bằng công thức đã được kiểm chứng. Công thức tính CKD-EPI) thường được ưa thích hơn. eGFR được tính trực tuyến có sẵn tại website: nkdep.nih.gov. EGFR liên tục <60 mL / phút / 1,73 m2 được coi là bất thường, dù ngưỡng tối ưu cho chẩn đoán lâm sàng vẫn còn tranh luận ở người lớn tuổi.
Chẩn đoán bệnh thận đái tháo đường (DKD)
DKD là một chẩn đoán lâm sàng được thực hiện dựa trên sự hiện diện của albumin niệu và / hoặc giảm eGFR trong trường hợp không có dấu hiệu hoặc triệu chứng của các nguyên nhân chính gây tổn thương thận khác. Biểu hiện điển hình của DKD được xem bao gồm một thời gian dài mắc bệnh đái tháo đường, bệnh võng mạc, albumin niệu mà không có đái máu đại thể, và eGFR giảm dần. Tuy nhiên, các dấu hiệu của DKD có thể xuất hiện ngay khi được chẩn đoán hoặc không có bệnh lý võng mạc ở bệnh nhân ĐTĐ típ 2 và eGFR giảm mà không có albumin niệu thường được báo cáo ở bệnh nhân ĐTĐ típ 1 và típ 2 và ngày càng trở nên phổ biến hơn theo thời gian khi tỷ lệ mắc ĐTĐ ngày càng tăng.
Các trụ niệu (chứa các hồng cầu hoặc bạch cầu hoặc xác tế bào), tăng nhanh albumin niệu hoặc hội chứng thận hư, eGFR giảm nhanh, hoặc không có bệnh lý võng mạc (ở bệnh nhân ĐTĐ típ 1) gợi ý các nguyên nhân thay thế hoặc bổ sung của bệnh thận. Đối với những bệnh nhân có những đặc điểm này, nên xem xét tiến hành các xét nghiệm chuyên sâu bao gồm cả khả năng sinh thiết thận để xác định chẩn đoán. Rất hiếm khi bệnh nhân ĐTĐ típ 1 tiến triển thành DKD mà không có bệnh lý võng mạc. Ở bệnh nhân ĐTĐ típ 2, bệnh võng mạc chỉ nhạy cảm và đặc hiệu vừa phải đối với DKD, được xác định bằng sinh thiết thận
Giai đoạn bệnh thận mạn (CKD)
Giai đoạn 1–2 CKD được xác định bằng bằng chứng về albumin niệu cao với eGFR ≥60 mL / phút / 1,73 m2, trong khi giai đoạn 3–5 CKD được xác định bằng khoảng eGFR thấp dần (Hình bên dưới). Ở bất kỳ eGFR nào, mức độ albumin niệu có liên quan đến nguy cơ mắc bệnh tim mạch (CVD), tiến triển CKD và tử vong. Do đó, Tổ chức Cải thiện Kết quả Toàn cầu Bệnh thận (KDIGO) khuyến nghị một giai đoạn CKD toàn diện hơn kết hợp albumin niệu ở tất cả các giai đoạn của eGFR. Hệ thống này có liên quan chặt chẽ hơn với nguy cơ nhưng cũng phức tạp hơn và không chuyển trực tiếp đến các quyết định điều trị. Do đó, dựa trên hệ thống phân loại hiện tại, cả eGFR và albumin niệu đều phải được định lượng để hướng dẫn các quyết định điều trị. Điều này rất quan trọng vì mức eGFR rất cần thiết để điều chỉnh liều lượng hoặc hạn chế sử dụng thuốc (Hình bên dưới). Mức độ albumin niệu sẽ ảnh hưởng đến việc lựa chọn thuốc hạ huyết áp hoặc thuốc hạ đường huyết. Tiền sử giảm eGFR được quan sát (cũng có liên quan đến nguy cơ tiến triển CKD và các kết quả sức khỏe bất lợi khác) và nguyên nhân gây tổn thương thận (bao gồm các nguyên nhân có thể khác ngoài ĐTĐ) cũng có thể ảnh hưởng đến các quyết định này.
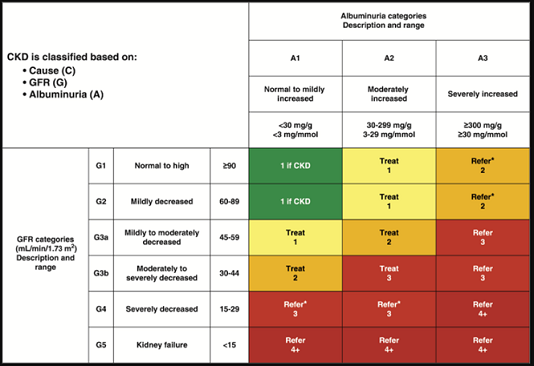
Hình trên, mô tả nguy cơ tiến triển của CKD, tần suất khám và giới thiệu đến bác sĩ chuyên theo mức lọc cầu thận (GFR) và albumin niệu. GFR và lưới albumin niệu mô tả nguy cơ tiến triển, bệnh tật và tử vong theo màu sắc, từ tốt nhất đến xấu nhất (xanh lá cây, vàng, cam, đỏ, đỏ sẫm). Các con số trong các ô là chỉ dẫn về tần suất khám bệnh (số lần mỗi năm). Màu xanh lá cây có thể phản ánh CKD với eGFR bình thường và tỷ lệ UACR chỉ khi có các dấu hiệu tổn thương thận khác, chẳng hạn như hình ảnh cho thấy bệnh thận đa nang hoặc bất thường sinh thiết thận, với các phép đo theo dõi hàng năm; màu vàng cần thận trọng và đo ít nhất một lần mỗi năm; màu cam yêu cầu đo hai lần mỗi năm; màu đỏ yêu cầu các phép đo ba lần mỗi năm; và màu đỏ sẫm yêu cầu đo bốn lần mỗi năm.
Tổn thương thận cấp
Tổn thương thận cấp (AKI) được chẩn đoán bằng sự gia tăng bền vững creatinine huyết thanh từ 50% trở lên trong một thời gian ngắn, điều này cũng được phản ánh là sự giảm nhanh chóng eGFR. Bệnh nhân ĐTĐ có nguy cơ mắc AKI cao hơn những người không mắc ĐTĐ. Các yếu tố nguy cơ khác đối với AKI bao gồm CKD đã có từ trước, sử dụng thuốc gây ảnh hưởng đến chức năng thận (chẳng hạn: thuốc kháng viêm không steroid) và sử dụng thuốc làm thay đổi lưu lượng máu qua thận và huyết động học nội thận. Đặc biệt, nhiều loại thuốc hạ huyết áp (chẳng hạn: thuốc lợi tiểu, thuốc ức chế men chuyển và thuốc chẹn thụ thể angiotensin [ARB]) có thể làm giảm thể tích nội mạch, lưu lượng máu qua thận và / hoặc độ lọc cầu thận. Có lo ngại rằng các chất ức chế kênh đồng vận chuyển natri-glucose (SGLT2) có thể thúc đẩy AKI thông qua suy giảm thể tích, đặc biệt khi kết hợp với thuốc lợi tiểu hoặc các thuốc khác làm giảm mức lọc cầu thận. Tuy nhiên, điều này không được chứng minh là đúng trong các thử nghiệm kết quả lâm sàng ngẫu nhiên hoặc nguy cơ bệnh tim mạch cao với chức năng thận bình thường. Cũng cần lưu ý rằng các chất đối kháng thụ thể mineralocorticoid không steroid (MRA) không làm tăng nguy cơ mắc AKI khi được sử dụng để làm chậm sự tiến triển của CKD. Việc xác định và điều trị AKI kịp thời là rất quan trọng vì AKI có liên quan đến việc tăng nguy cơ mắc CKD tiến triển và các kết quả sức khỏe kém khác.
Tăng creatinin huyết thanh nhẹ (lên đến 30% so với ban đầu) với thuốc ức chế hệ renin-angiotensin (RAS) (như thuốc ức chế ACE và ARB) không được nhầm lẫn với AKI. Một phân tích về thử nghiệm Hành động để Kiểm soát nguy cơ Tim mạch trong ở bệnh nhân Đái tháo đường có tăng huyết áp (ACCORD BP) chứng minh rằng những người ngẫu nhiên làm giảm huyết áp tích cực với mức tăng creatinine huyết thanh lên đến 30% không có bất kỳ sự gia tăng nào về tỷ lệ tử vong hoặc CKD tiến triển. Hơn nữa, một phép đo các chất đánh dấu cho AKI cho thấy không có sự gia tăng đáng kể của bất kỳ dấu hiệu nào có creatinine tăng. Do đó, không nên ngừng sử dụng thuốc ức chế men chuyển và ARB khi tăng nhẹ creatinin huyết thanh (<30%), trong trường hợp không giảm thể tích.
Cuối cùng, cần lưu ý rằng thuốc ức chế men chuyển và ARB thường không được dùng ở liều dung nạp tối đa vì sợ rằng creatinin huyết thanh sẽ tăng. Như đã lưu ý ở trên, đây là một lỗi. Lưu ý rằng trong tất cả các thử nghiệm lâm sàng chứng minh hiệu quả của thuốc ức chế men chuyển và ARB trong việc làm chậm sự tiến triển của bệnh thận, liều lượng dung nạp tối đa đã được sử dụng - không phải liều quá thấp không mang lại lợi ích. Hơn nữa, hiện nay đã có các nghiên cứu chứng minh lợi ích kết quả trên cả tỷ lệ tử vong và làm chậm tiến triển CKD ở những người mắc bệnh tiểu đường có eGFR <30 mL / phút / 1,73 m2 (37). Ngoài ra, khi tăng creatinin huyết thanh lên đến 30% và không có tăng kali huyết kèm theo, nên tiếp tục phong tỏa RAS.
Giám sát
Cả albumin niệu và eGFR nên được theo dõi hàng năm để có thể chẩn đoán CKD kịp thời, theo dõi sự tiến triển của CKD, phát hiện các bệnh thận chồng chất bao gồm AKI, đánh giá nguy cơ biến chứng CKD, liều lượng thuốc thích hợp. Trong số những người mắc bệnh thận hiện hữu, albumin niệu và eGFR có thể thay đổi do sự tiến triển của CKD, sự phát triển của một nguyên nhân chồng chất riêng biệt của bệnh thận, AKI hoặc các tác dụng khác của thuốc, như đã lưu ý ở trên. Kali huyết thanh cũng nên được theo dõi ở những bệnh nhân được điều trị bằng thuốc lợi tiểu vì những thuốc này có thể gây hạ kali máu, có liên quan đến nguy cơ tim mạch và tử vong. Đối với những bệnh nhân có eGFR <60 mL/phút/1,73 m2, những người dùng thuốc ức chế men chuyển, ARB hoặc MRA nên đo kali huyết thanh định kỳ. Ngoài ra, những người có phạm vi eGFR thấp hơn này nên được xác định liều lượng thích hợp, nên giảm thiểu việc tiếp xúc với các thuốc độc cho thận (ví dụ: thuốc chống viêm không steroid và thuốc cản quang có i-ốt) và nên đánh giá các biến chứng CKD tiềm ẩn.
Cần phải đánh giá định lượng albumin niệu hàng năm. Điều này đặc biệt đúng sau khi chẩn đoán albumin niệu, sử dụng thuốc ức chế men chuyển hoặc điều trị ARB đến liều dung nạp tối đa và kiểm soát được huyết áp. Những thay đổi sớm về chức năng thận có thể được phát hiện bằng sự gia tăng albumin niệu trước khi thay đổi eGFR và điều này cũng ảnh hưởng đáng kể đến nguy cơ tim mạch. Ngoài ra, mức giảm ban đầu >30% so với mức ban đầu được đo, sau đó được duy trì trong ít nhất 2 năm, được Phân Ban Tim mạch và Thận học của Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) coi là đại diện hợp lệ cho lợi ích bảo vệ thận. Tiếp tục theo dõi có thể đánh giá cả đáp ứng với điều trị và tiến triển bệnh và có thể hỗ trợ đánh giá tuân thủ điều trị bằng thuốc ức chế men chuyển hoặc ARB. Ngoài ra, trong các thử nghiệm lâm sàng về thuốc ức chế men chuyển hoặc liệu pháp ARB ở bệnh đái tháo đường típ 2, việc giảm albumin niệu xuống mức <300 mg/g Cr hoặc >30% so với mức ban đầu có liên quan đến việc cải thiện kết quả về thận và tim mạch, dẫn đến một số gợi ý rằng thuốc nên được chuẩn độ để giảm tối đa UACR. Dữ liệu từ các phân tích đoàn hệ cho thấy ít lợi ích hơn đối với kết cục tim thận với một nửa liều ức chế hệ RAS. Ở bệnh đái tháo đường týp 1, sự thuyên giảm albumin niệu có thể xảy ra một cách tự nhiên, và các nghiên cứu đoàn hệ đánh giá mối liên quan giữa sự thay đổi albumin niệu với kết quả lâm sàng đã báo cáo kết quả không nhất quán.
Tỷ lệ biến chứng CKD tương quan với eGFR. Khi eGFR <60 mL/phút/1,73 m2, sàng lọc các biến chứng của CKD được chỉ định. Tiêm vắc-xin sớm ngừa nhiêm vi-rút viêm gan B được chỉ định ở những bệnh nhân có khả năng tiến triển thành ESRD.
CÁC CAN THIỆP
Dinh dưỡng
Đối với những người mắc bệnh CKD không chạy thận nhân tạo, lượng protein trong chế độ ăn nên ở mức ∼0,8 g/kg trọng lượng cơ thể mỗi ngày (mức cho phép hàng ngày được khuyến nghị). So với mức hấp thụ protein trong chế độ ăn cao hơn, mức này làm chậm quá trình suy giảm GFR với bằng chứng về tác động lớn hơn theo thời gian. Mức protein cao hơn trong chế độ ăn (>20% lượng calo hàng ngày từ protein hoặc >1,3 g/kg/ngày) có liên quan đến tăng albumin niệu, mất chức năng thận nhanh hơn và tử vong do bệnh tim mạch và do đó nên tránh. Không nên giảm lượng protein trong chế độ ăn xuống dưới mức cho phép hàng ngày được khuyến nghị là 0,8 g/kg/ngày vì nó không làm thay đổi các biện pháp đo đường huyết, đo nguy cơ tim mạch hoặc quá trình giảm GFR.
Hạn chế natri trong chế độ ăn (đến <2.300 mg/ngày) có thể hữu ích để kiểm soát huyết áp và giảm nguy cơ tim mạch, và hạn chế kali trong chế độ ăn uống có thể cần thiết để kiểm soát nồng độ kali huyết thanh. Những biện pháp can thiệp này có thể quan trọng, nhất là đối với những bệnh nhân bị giảm eGFR, những người mà sự bài tiết natri và kali qua nước tiểu có thể bị suy giảm. Đối với những bệnh nhân chạy thận nhân tạo, nên cân nhắc lượng protein trong chế độ ăn ở mức cao hơn, vì suy dinh dưỡng là một vấn đề lớn ở một số bệnh nhân chạy thận nhân tạo. Các khuyến nghị về lượng natri và kali trong chế độ ăn uống nên được cá nhân hóa trên cơ sở các tình trạng bệnh đi kèm, sử dụng thuốc, huyết áp và kết quả xét nghiệm.
Mục tiêu đường huyết
Kiểm soát đường huyết tích cực với mục tiêu đạt được đường huyết gần bình thường đã được chứng minh trong các nghiên cứu ngẫu nhiên tiền cứu lớn để trì hoãn sự khởi phát và tiến triển của albumin niệu và giảm eGFR ở bệnh nhân đái tháo đường típ 1 và đái tháo đường týp 2. Insulin đơn thuần đã được sử dụng để hạ đường huyết trong nghiên cứu Thử nghiệm Kiểm soát và Biến chứng Bệnh tiểu đường (DCCT)/Dịch tễ học về Can thiệp và Biến chứng Bệnh tiểu đường (EDIC) về bệnh đái tháo đường típ 1, trong khi nhiều loại thuốc được sử dụng trong các thử nghiệm lâm sàng về bệnh đái tháo đường típ 2, hỗ trợ kết luận rằng bản thân việc kiểm soát đường huyết giúp ngăn ngừa CKD và sự tiến triển của nó. Tác dụng của các liệu pháp hạ đường huyết đối với CKD đã giúp xác định các mục tiêu A1C.
Sự hiện diện của CKD ảnh hưởng đến nguy cơ và lợi ích của việc kiểm soát đường huyết tích cực và một số loại thuốc hạ đường huyết cụ thể. Trong thử nghiệm Hành động để kiểm soát nguy cơ tim mạch ở bệnh đái tháo đường (ACCORD) đối với bệnh đái tháo đường típ 2, tác dụng phụ của việc kiểm soát đường huyết tích cực (hạ đường huyết và tử vong) đã tăng lên ở những bệnh nhân mắc bệnh thận lúc ban đầu. Hơn nữa, có một khoảng thời gian trễ ít nhất là 2 năm đối với bệnh đái tháo đường típ 2 đến hơn 10 năm đối với bệnh đái tháo đường típ 1 để tác dụng của kiểm soát đường huyết tích cực biểu hiện như kết quả eGFR được cải thiện. Do đó, ở một số bệnh nhân mắc CKD phổ biến và có nhiều bệnh kèm theo, mức A1C mục tiêu có thể ít nghiêm trọng hơn.
Ảnh hưởng trực tiếp đến thận của thuốc hạ đường huyết
Một số loại thuốc hạ đường huyết cũng có tác dụng trực tiếp lên thận, tức là không qua trung gian đường huyết. Ví dụ, thuốc ức chế SGLT2 làm giảm tái hấp thu glucose ở ống thận, cân nặng, huyết áp hệ thống, áp lực trong cầu thận, albumin niệu và làm chậm quá trình mất GFR thông qua các cơ chế xuất hiện độc lập với đường huyết. Hơn nữa, dữ liệu gần đây ủng hộ quan điểm cho rằng các chất ức chế SGLT2 làm giảm hơn 50% stress oxy hóa ở thận và làm giảm angiotensinogen cũng như giảm hoạt động gây viêm của NLRP3. Chất chủ vận thụ thể glucagon-like peptide 1 (GLP-1 RAs) cũng có tác dụng trực tiếp lên thận và đã được báo cáo là cải thiện kết quả thận so với giả dược. Nên cân nhắc các tác động lên thận khi lựa chọn các thuốc hạ đường huyết.
Lựa chọn thuốc hạ đường huyết cho bệnh nhân mắc bệnh thận mạn
Đối với bệnh nhân đái tháo đường típ 2 và đã mắc bệnh CKD, những cân nhắc đặc biệt đối với việc lựa chọn thuốc hạ đường huyết bao gồm những hạn chế đối với các loại thuốc có sẵn khi eGFR bị giảm và mong muốn giảm thiểu nguy cơ cao tiến triển CKD, CVD và hạ đường huyết. Liều lượng thuốc có thể yêu cầu điều chỉnh với eGFR <60 mL/phút/1,73 m2.
FDA đã sửa đổi hướng dẫn sử dụng metformin trong bệnh thận mạn vào năm 2016, khuyến nghị sử dụng eGFR thay vì creatinine huyết thanh để hướng dẫn điều trị và mở rộng nhóm bệnh nhân mắc bệnh thận nên cân nhắc điều trị bằng metformin. Hướng dẫn sửa đổi của FDA nêu rõ rằng metformin chống chỉ định ở những bệnh nhân có eGFR <30 mL/phút/1,73 m2; eGFR nên được theo dõi trong khi dùng metformin; nên đánh giá lại lợi ích và rủi ro của việc tiếp tục điều trị khi eGFR giảm xuống <45 mL/phút/1,73 m2; không nên bắt đầu dùng metformin cho bệnh nhân có eGFR <45 mL/phút/1,73 m2; và metformin nên tạm thời ngừng sử dụng tại thời điểm hoặc trước khi thực hiện các thủ thuật chụp ảnh cản quang có i-ốt ở những bệnh nhân có eGFR 30–60 mL/phút/1,73 m2. Trong những hạn chế này, metformin có thể được coi là phương pháp điều trị ban đầu để kiểm soát đường huyết cho tất cả bệnh nhân đái tháo đường típ 2, bao gồm cả những người mắc bệnh thận mạn giai đoạn đầu.
Thuốc ức chế SGLT2 nên được dùng cho tất cả bệnh nhân mắc CKD giai đoạn 3 trở lên và đái tháo đường típ 2 bất kể kiểm soát đường huyết, vì chúng làm chậm tiến triển của CKD và giảm nguy cơ suy tim không phụ thuộc vào kiểm soát đường huyết. GLP-1 RA được đề xuất để giảm nguy cơ tim mạch nếu nguy cơ đó là vấn đề nổi bật, vì chúng làm giảm nguy cơ biến cố CVD và hạ đường huyết và dường như có thể làm chậm tiến triển của CKD.
Một số thử nghiệm về kết quả tim mạch lớn ở bệnh nhân đái tháo đường típ 2 có nguy cơ cao mắc bệnh tim mạch hoặc bệnh nhân mắc bệnh tim mạch hiện tại đã xem xét các ảnh hưởng đến thận như là kết quả phụ. Các thử nghiệm này bao gồm EMPA-REG OUTCOME [BI 10773 (Empagliflozin) Thử nghiệm Biến cố Kết cục Tim mạch ở Bệnh nhân Đái tháo đường típ 2], CANVAS (Nghiên cứu Đánh giá Kết quả Tim mạch Canagliflozin), LEADER (Hiệu quả và Tác dụng của Liraglutide trong Bệnh Tiểu đường: Đánh giá Kết quả Kết cục Tim mạch), và SUSTAIN-6 (Thử nghiệm để đánh giá kết quả tim mạch và các kết quả lâu dài khác với Semaglutide ở những đối tượng mắc bệnh đái tháo đường típ 2). Cụ thể, so với giả dược, empagliflozin làm giảm 39% nguy cơ biến cố hoặc làm nặng thêm bệnh thận (tổng hợp tiến triển thành UACR >300 mg/g Cr, tăng gấp đôi creatinine huyết thanh, ESRD hoặc tử vong do ESRD) và giảm gấp đôi nguy cơ mắc bệnh thận mãn tính. creatinine huyết thanh kèm theo eGFR ≤45 mL/phút/1,73 m2 bằng 44%; canagliflozin làm giảm 27% nguy cơ tiến triển thành albumin niệu và 40% nguy cơ giảm eGFR, ESRD hoặc tử vong do ESRD; liraglutide làm giảm 22% nguy cơ mắc bệnh thận mới hoặc xấu đi (một tổ hợp gồm albumin niệu đại thể dai dẳng, tăng gấp đôi creatinine huyết thanh, ESRD hoặc tử vong do ESRD); và semaglutide làm giảm 36% nguy cơ mắc bệnh thận mới hoặc bệnh thận nặng hơn (kết hợp của UACR kéo dài >300 mg/g Cr, tăng gấp đôi creatinine huyết thanh hoặc ESRD) (mỗi P < 0,01).
Những phân tích này bị giới hạn bởi việc đánh giá các quần thể nghiên cứu không được chọn chủ yếu cho CKD và kiểm tra các tác động lên thận như là kết quả phụ. Tuy nhiên, tất cả các thử nghiệm này đều bao gồm một số lượng lớn người mắc bệnh thận giai đoạn 3a (eGFR 45–59 mL/phút/1,73 m2). Ngoài ra, các phân tích phân nhóm của CANVAS và LEADER gợi ý rằng lợi ích trên thận của canagliflozin và liraglutide là lớn hoặc cao hơn đối với những người tham gia mắc CKD lúc ban đầu (30,72) và trong CANVAS là tương tự đối với những người tham gia mắc hoặc không mắc bệnh tim mạch do xơ vữa động mạch (ASCVD) tại đường cơ sở.
Một số thử nghiệm lâm sàng lớn về thuốc ức chế SGLT2 tập trung vào những bệnh nhân mắc CKD tiến triển và việc đánh giá kết quả ban đầu về thận đã được hoàn thành hoặc đang diễn ra. Canagliflozin và các biến cố thận ở bệnh nhân đái tháo đường đã được đánh giá lâm sàng bệnh thận (CREDENCE), một thử nghiệm canagliflozin có đối chứng với giả dược ở 4.401 người trưởng thành mắc bệnh tiểu đường týp 2, UACR ≥300 mg/g Cr, và eGFR trung bình 56 mL/phút/1,73 m2 với a mức albumin niệu trung bình trên 900 mg/ngày, có tiêu chí tổng hợp chính là ESRD, tăng gấp đôi creatinine huyết thanh, hoặc tử vong do thận hoặc tim mạch. Nó đã được dừng lại sớm do hiệu quả tích cực và cho thấy giảm 32% nguy cơ phát triển ESRD so với kiểm soát. Ngoài ra, sự phát triển của tiêu chí chính, bao gồm lọc máu mạn tính trong ≥30 ngày, ghép thận hoặc eGFR <15 mL/phút/1,73 m2 duy trì trong ≥30 ngày theo đánh giá của phòng thí nghiệm trung tâm, tăng gấp đôi so với mức trung bình creatinine huyết thanh ban đầu được duy trì trong ≥30 ngày theo đánh giá của phòng thí nghiệm trung tâm, hoặc tử vong do thận hoặc tử vong do tim mạch, đã giảm 30%. Lợi ích này là trên nền tảng thuốc ức chế men chuyển hoặc liệu pháp ARB ở >99% bệnh nhân. Hơn nữa, trong nhóm CKD tiến triển này, có những lợi ích rõ ràng về kết cục tim mạch thể hiện là giảm 31% tử vong do tim mạch hoặc nhập viện do suy tim và giảm 20% tử vong do tim mạch, nhồi máu cơ tim không tử vong hoặc đột quỵ không tử vong.
Thử nghiệm thứ hai đối với bệnh thận do đái tháo đường tiến triển là nghiên cứu Dapagliflozin và Phòng ngừa Kết quả Bất lợi trong Bệnh Thận Mãn tính (DAPA-CKD). Thử nghiệm này đã kiểm tra một nhóm thuần tập tương tự như trong CREDENCE; tuy nhiên, các điểm cuối có một chút khác biệt. Kết quả chính là thời gian xảy ra lần đầu tiên bất kỳ thành phần nào của hỗn hợp bao gồm eGFR giảm ≥50% hoặc đạt đến ESRD hoặc tử vong do tim mạch hoặc tử vong do thận. Các phép đo kết quả phụ bao gồm thời gian cho đến khi xuất hiện lần đầu tiên bất kỳ thành phần nào của kết cục thận tổng hợp (eGFR giảm ≥50% hoặc đạt đến ESRD hoặc tử vong do thận), thời gian đến khi xuất hiện lần đầu tiên một trong các thành phần của kết quả tổng hợp tim mạch ( tử vong do tim mạch hoặc nhập viện vì suy tim), và cuối cùng là thời gian dẫn đến tử vong do mọi nguyên nhân. Thử nghiệm có 4.304 người tham gia với eGFR trung bình lúc ban đầu là 43,1 ± 12,4 mL/phút/1,73 m2, UACR trung bình là 949 mg/g và 67,5% người tham gia mắc bệnh tiểu đường loại 2. Dapagliflozin mang lại lợi ích đáng kể cho tiêu chí đánh giá chính (tỷ số nguy cơ 0,61 [KTC 95% 0,51–0,72]; P < 0,001).
Tỷ lệ nguy cơ đối với tổ hợp thận của sự suy giảm kéo dài eGFR ≥50%, giai đoạn cuối giai đoạn cuối hoặc tử vong do nguyên nhân thận là 0,56 (KTC 95% 0,45–0,68; P < 0,001). Tỷ số nguy cơ đối với tử vong do nguyên nhân tim mạch hoặc nhập viện vì suy tim là 0,71 (KTC 95% 0,55–0,92; P = 0,009). Cuối cùng, tỷ lệ tử vong do mọi nguyên nhân đã giảm ở nhóm dapagliflozin so với nhóm giả dược (P < 0,004).
Ngoài tác dụng trên thận, trong khi thuốc ức chế SGLT2 chứng minh giảm nguy cơ nhập viện do suy tim, một số thuốc cũng chứng minh giảm nguy cơ tim mạch. GLP-1 RAs đã chứng minh rõ ràng lợi ích tim mạch. Cụ thể, trong EMPA-REG OUTCOME, CANVAS, DECLARE, LEADER và SUSTAIN-6, empagliflozin, canagliflozin, dapagliflozin, liraglutide và semaglutide, tương ứng, mỗi biến cố tim mạch đều giảm, được đánh giá là kết quả chính, so với giả dược (xem Phần 10, “Quản lý rủi ro và bệnh tim mạch,” , để thảo luận thêm). Trong khi tác dụng hạ đường huyết của thuốc ức chế SGLT2 bị giảm đi với eGFR <45 mL/phút/1,73 m2, lợi ích về thận và tim mạch vẫn được ghi nhận ở mức eGFR 25 mL/phút/1,73 m2 mà không có thay đổi đáng kể về glucose. Hầu hết những người tham gia mắc CKD trong các thử nghiệm này cũng đã được chẩn đoán ASCVD ngay từ đầu, mặc dù ∼28% người tham gia CANVAS mắc CKD không được chẩn đoán ASCVD.
Dựa trên bằng chứng từ thử nghiệm CREDENCE và các phân tích thứ cấp của các thử nghiệm về kết quả tim mạch với thuốc ức chế SGLT2, các biến cố tim mạch và thận giảm khi sử dụng thuốc ức chế SGLT2 ở những bệnh nhân có eGFR là 30 mL/phút/1,73 m2, không phụ thuộc vào tác dụng hạ đường huyết.
Mặc dù rõ ràng có giảm nguy cơ tim mạch liên quan đến việc sử dụng GLP-1 RA ở bệnh nhân tiểu đường loại 2 và CKD, bằng chứng về lợi ích trên kết quả thận sẽ đi kèm với kết quả của FLOW đang diễn ra (Một nghiên cứu để xem Semaglutide hoạt động như thế nào so với Thử nghiệm giả dược ở những người mắc bệnh đái tháo đường típ 2 và bệnh thận mãn tính) với semaglutide dạng tiêm. Như đã lưu ý ở trên, dữ liệu được công bố đề cập đến một nhóm hạn chế bệnh nhân CKD, chủ yếu mắc ASCVD cùng tồn tại. Tuy nhiên, các biến cố về thận đã được xem xét như cả kết quả chính và phụ trong các thử nghiệm lớn đã được công bố. Ngoài ra, hồ sơ sự kiện bất lợi của các đại lý này phải được xem xét.
Đối với bệnh nhân đái tháo đường típ 2 và bệnh thận mạn, việc lựa chọn thuốc cụ thể có thể phụ thuộc vào bệnh đi kèm và giai đoạn bệnh thận mạn. Thuốc ức chế SGLT2 có thể hữu ích hơn cho những bệnh nhân có nguy cơ tiến triển CKD cao (tức là có albumin niệu hoặc tiền sử mất eGFR được ghi nhận) vì chúng dường như có tác dụng có lợi lớn đối với tỷ lệ mắc CKD. Thuốc ức chế SGLT2 empagliflozin và dapagliflozin được FDA chấp thuận sử dụng với eGFR 25–45 mL/phút/1,73 m2 đối với kết quả suy thận/tim. Empagliflozin có thể được bắt đầu với eGFR >30 mL/phút/1,73 m2 (mặc dù các thử nghiệm then chốt đối với từng người tham gia có eGFR ≥30 mL/phút/1,73 m2 và đã chứng minh lợi ích ở các phân nhóm có eGFR thấp). Canagliflozin được chấp thuận để bắt đầu giảm xuống mức eGFR là 30 mL/phút/1,73 m2. Một số RA GLP-1 yêu cầu điều chỉnh liều để giảm eGFR.
Kết quả trên thận và tim mạch của thuốc đối kháng thụ thể Mineralocorticoid trong bệnh thận mạn
MRA trước đây chưa được nghiên cứu kỹ về bệnh thận đái tháo đường vì nguy cơ tăng kali máu. Tuy nhiên, dữ liệu hiện có cho thấy lợi ích duy trì trong việc giảm albumin niệu. Có hai loại MRA khác nhau, steroid và không steroid, với một nhóm không thể ngoại suy cho nhóm kia. Vào cuối năm 2020, kết quả của thử nghiệm đầu tiên trong số hai thử nghiệm, thử nghiệm Finerenone trong Giảm suy thận và tiến triển bệnh ở bệnh thận do tiểu đường (FIDELIO-DKD), đã kiểm tra tác dụng trên thận của finerenone, đã cho thấy sự giảm đáng kể tiến triển của bệnh thận do tiểu đường và các biến cố tim mạch ở bệnh nhân mắc bệnh thận đái tháo đường tiến triển. Thử nghiệm này có điểm kết thúc chính về thời gian cho đến lần xuất hiện đầu tiên của điểm kết thúc tổng hợp khởi phát suy thận, eGFR giảm liên tục >40% so với ban đầu trong ít nhất 4 tuần hoặc tử vong do thận. Một kết quả phụ được xác định trước là thời gian xảy ra lần đầu tiên tiêu chí tổng hợp tử vong do tim mạch hoặc các biến cố tim mạch không gây tử vong (nhồi máu cơ tim, đột quỵ, nhập viện vì suy tim). Các kết cục phụ khác bao gồm tử vong do mọi nguyên nhân, thời gian đến khi nhập viện do mọi nguyên nhân và thời gian đến khi xuất hiện lần đầu tiên tiêu chí tổng hợp sau: khởi phát suy thận, eGFR giảm liên tục ≥57% so với ban đầu trong ít nhất 4 tuần hoặc tử vong do thận và thay đổi UACR từ lúc ban đầu đến tháng thứ 4.
Thử nghiệm mù đôi, kiểm soát giả dược đã chọn ngẫu nhiên 5.734 bệnh nhân mắc bệnh CKD và bệnh tiểu đường loại 2 để nhận finerenone, một MRA không steroid mới hoặc giả dược. Những bệnh nhân đủ điều kiện có UACR từ 30 đến <300 mg/g, eGFR từ 25 đến <60 mL/phút/1,73 m2 và bệnh võng mạc tiểu đường, hoặc UACR từ 300–5.000 mg/g và eGFR từ 25 đến <75 mL/phút/1,73 m2. Tuổi trung bình của bệnh nhân là 65,6 tuổi và 30% là nữ. eGFR trung bình là 44,3 mL/phút/1,73 m2. Albumin niệu trung bình (khoảng tứ phân vị) là 852 (446–1.634) mg/g. Tiêu chí chính giảm khi dùng finerenone so với giả dược (tỷ lệ rủi ro 0,82, KTC 95% 0,73–0,93; P = 0,001), cũng như tiêu chí phụ chính của kết cục tim mạch (tỷ lệ rủi ro 0,86, KTC 95% 0,75–0,99; P = 0,03). Tăng kali máu dẫn đến 2,3% ngừng thuốc trong nhóm nghiên cứu so với 0,9% ở nhóm giả dược. Tuy nhiên, nghiên cứu đã hoàn thành và không có trường hợp tử vong nào liên quan đến tăng kali máu. Đáng chú ý, 4,5% tổng số nhóm đang được điều trị bằng thuốc ức chế SGLT2.
Bệnh tim mạch và huyết áp
Tăng huyết áp là một yếu tố nguy cơ lớn đối với sự phát triển và tiến triển của CKD. Điều trị hạ huyết áp làm giảm nguy cơ albumin niệu và ở những bệnh nhân đái tháo đường típ 1 hoặc 2 có bệnh thận mạn (eGFR <60 mL/phút/1,73 m2 và UACR ≥300 mg/g Cr), liệu pháp ức chế men chuyển hoặc ARB giảm nguy cơ tiến triển thành ESRD (101–103). Hơn nữa, liệu pháp hạ huyết áp làm giảm nguy cơ biến cố tim mạch.
Mức huyết áp <140/90 mmHg thường được khuyến nghị để giảm tỷ lệ tử vong do CVD và làm chậm tiến triển CKD ở tất cả những người mắc bệnh tiểu đường. Các mục tiêu huyết áp thấp hơn (ví dụ: <130/80 mmHg) nên được xem xét cho bệnh nhân dựa trên lợi ích và rủi ro dự đoán của từng cá nhân. Bệnh nhân bị CKD có nguy cơ tiến triển thành CKD (đặc biệt là những người có albumin niệu) và CVD và do đó, mục tiêu huyết áp thấp hơn có thể phù hợp trong một số trường hợp, đặc biệt ở những người có albumin niệu ≥300 mg/g Cr.
Thuốc ức chế men chuyển hoặc ARB là thuốc ưu tiên hàng đầu để điều trị huyết áp ở bệnh nhân tiểu đường, tăng huyết áp, eGFR <60 mL/phút/1,73 m2 và UACR ≥300 mg/g Cr vì những lợi ích đã được chứng minh trong việc ngăn ngừa tiến triển của CKD. Nói chung, thuốc ức chế ACE và ARB được coi là có lợi ích (105,106) và rủi ro tương tự nhau. Trong bối cảnh mức độ albumin niệu thấp hơn (30–299 mg/g Cr), liệu pháp ức chế men chuyển hoặc ARB ở liều dung nạp tối đa trong các thử nghiệm đã làm giảm tiến triển thành albumin niệu nặng hơn (≥300 mg/g Cr), làm chậm tiến triển của CKD và giảm các biến cố tim mạch nhưng không làm giảm tiến triển thành ESRD. Mặc dù thuốc ức chế men chuyển hoặc ARB thường được kê đơn cho bệnh nhân có albumin niệu cao mà không bị tăng huyết áp, các thử nghiệm kết quả chưa được thực hiện trong bối cảnh này để xác định liệu chúng có cải thiện kết quả thận hay không. Hơn nữa, hai nghiên cứu mù đôi dài hạn đã chứng minh không có tác dụng bảo vệ thận của thuốc ức chế men chuyển hoặc ARB ở bệnh đái tháo đường típ 1 và 2 ở những người huyết áp bình thường có hoặc không có albumin niệu cao (trước đây là albumin niệu vi lượng).
Không có bệnh thận, thuốc ức chế men chuyển hoặc ARB rất hữu ích để kiểm soát huyết áp nhưng chưa được chứng minh là vượt trội so với các nhóm liệu pháp hạ huyết áp thay thế, bao gồm thuốc lợi tiểu giống thiazide và thuốc chẹn kênh canxi dihydropyridin. Trong một thử nghiệm trên những người mắc đái tháo đường típ 2 và bài tiết albumin trong nước tiểu bình thường, ARB làm giảm hoặc ngăn chặn sự phát triển của albumin niệu nhưng lại làm tăng tỷ lệ biến cố tim mạch. Trong một thử nghiệm trên những người mắc bệnh đái tháo đường típ 1 không biểu hiện albumin niệu hay tăng huyết áp, thuốc ức chế men chuyển hoặc ARB không ngăn được sự phát triển của bệnh cầu thận đái tháo đường được đánh giá bằng sinh thiết thận. Điều này đã được hỗ trợ thêm bởi một thử nghiệm tương tự ở những bệnh nhân mắc đái tháo đường típ 2. Do đó, thuốc ức chế men chuyển hoặc ARB không được khuyến cáo cho bệnh nhân không bị tăng huyết áp để ngăn ngừa sự phát triển của CKD.
Hai thử nghiệm lâm sàng đã nghiên cứu sự kết hợp của thuốc ức chế ACE và ARB và không tìm thấy lợi ích nào đối với CVD hoặc CKD, và sự kết hợp thuốc có tỷ lệ tác dụng phụ cao hơn (tăng kali máu và/hoặc AKI). Do đó, nên tránh sử dụng kết hợp thuốc ức chế men chuyển và ARB.
Giới thiệu đến bác sĩ chuyên khoa thận
Cân nhắc chuyển đến bác sĩ chuyên khoa thận khi không chắc chắn về nguyên nhân của bệnh thận, đối với các vấn đề quản lý khó khăn (thiếu máu, cường cận giáp thứ phát, tăng đáng kể albumin niệu mặc dù kiểm soát huyết áp tốt, bệnh xương chuyển hóa, tăng huyết áp kháng trị hoặc rối loạn điện giải), hoặc khi có bệnh thận tiến triển (eGFR <30 mL/phút/1,73 m2) cần thảo luận về liệu pháp thay thế thận cho ESRD. Ngưỡng giới thiệu có thể khác nhau tùy thuộc vào tần suất mà nhà cung cấp gặp bệnh nhân mắc bệnh tiểu đường và bệnh thận. Tư vấn với bác sĩ chuyên khoa thận khi CKD giai đoạn 4 phát triển (eGFR <30 mL/phút/1,73 m2) đã được chứng minh là giúp giảm chi phí, cải thiện chất lượng chăm sóc và trì hoãn lọc máu. Tuy nhiên, các chuyên gia và nhà cung cấp dịch vụ khác cũng nên giáo dục bệnh nhân của họ về bản chất tiến triển của CKD, lợi ích bảo tồn thận của việc chủ động điều trị huyết áp và đường huyết, cũng như nhu cầu điều trị thay thế thận.
TỐM TẮT
Bệnh thận mạn (CKD)
Sàng lọc
Khuyến nghị
1a. Ít nhất mỗi năm, nên đánh giá albumin niệu (ví dụ: tỷ lệ albumin-creatinine trong nước tiểu) và mức lọc cầu thận ước tính ở bệnh nhân đái tháo đường típ 1 trong thời gian ≥5 năm và ở tất cả bệnh nhân đái tháo đường típ 2 bất kể tình trạng điều trị. B
1b. Bệnh nhân đái tháo đường và albumin niệu ≥300 mg/g creatinine và/hoặc mức lọc cầu thận ước tính 30–60 mL/phút/1,73 m2 nên được theo dõi hai lần mỗi năm để hướng dẫn điều trị. B
Điều trị
Khuyến nghị
2. Tối ưu hóa việc kiểm soát glucose để giảm nguy cơ hoặc làm chậm sự tiến triển của bệnh thận mạn. A
3a. Đối với bệnh nhân đái tháo đường típ 2 và bệnh thận do đái tháo đường, nên sử dụng thuốc ức chế đồng vận chuyển natri-glucose 2 (SGLT2) ở những bệnh nhân có mức lọc cầu thận ước tính ≥25 mL/phút/1,73 m2 và albumin niệu ≥300 mg/g creatinine được khuyến cáo để giảm tiến triển bệnh thận mạn và các biến cố tim mạch. B
3b. Ở bệnh nhân đái tháo đường típ 2 và bệnh thận mạn, cân nhắc sử dụng thêm thuốc ức chế đồng vận chuyển natri-glucose 2 (SGLT2) để giảm nguy cơ tim mạch khi mức lọc cầu thận ước tính và creatinine albumin niệu ≥25 mL/phút/1,73 m2 hoặc ≥300 mg/ g. A
3c. Ở những bệnh nhân mắc bệnh thận mạn có nguy cơ cao mắc các biến cố tim mạch hoặc tiến triển bệnh thận mạn hoặc không thể sử dụng chất ức chế đồng vận chuyển natri-glucose 2 (SLTL2), thuốc đối kháng thụ thể mineralocorticoid không steroid (finerenone) được khuyến cáo để giảm tiến triển bệnh thận mạnvà các biến cố tim mạch. A
3d. Ở những bệnh nhân mắc bệnh thận mạn có albumin niệu ≥300 mg/g, nên giảm 30% hoặc nhiều hơn lượng mg/g albumin niệu để làm chậm tiến triển của bệnh thận mạn. B
4. Nên tối ưu hóa kiểm soát huyết áp và giảm biến thiên huyết áp để giảm nguy cơ hoặc làm chậm tiến triển của bệnh thận mạn. A
5. Tiếp tục sự dùng thuốc chẹn hệ renin-angiotensin khi tăng nhẹ creatinine huyết thanh (≤30%) trong trường hợp không bị suy giảm thể tích tuần hoàn. A
6. Đối với những người mắc bệnh thận mạn giai đoạn 3 trở lên không chạy thận nhân tạo, lượng protein trong chế độ ăn nên tối đa là 0,8 g/kg trọng lượng cơ thể mỗi ngày (mức khuyến nghị hàng ngày). A
Đối với những bệnh nhân chạy thận nhân tạo, nên xem xét mức độ hấp thụ protein cao hơn trong chế độ ăn uống, vì suy dinh dưỡng là một vấn đề lớn ở một số bệnh nhân chạy thận nhân tạo. B
7. Ở những bệnh nhân không mang thai mắc đái tháo đường và tăng huyết áp, thuốc ức chế men chuyển hoặc thuốc ức chế thụ thể angiotensin được khuyến cáo cho những người có tỷ lệ albumin-creatinine trong nước tiểu tăng vừa phải (30–299 mg/g creatinine) B và được khuyến cáo mạnh cho những bệnh nhân có tỷ lệ albumin-creatinine ≥300 mg/g creatinine và/hoặc mức lọc cầu thận ước tính <60 mL/phút/1,73 m2. A
8. Theo dõi định kỳ nồng độ creatinine và kali trong huyết thanh để phát hiện tăng creatinine hoặc thay đổi kali khi sử dụng thuốc ức chế men chuyển, thuốc ức chế thụ thể angiotensin hoặc thuốc lợi tiểu. B
9. Thuốc ức chế men chuyển hoặc thuốc chẹn thụ thể angiotensin không được khuyến cáo để phòng ngừa ban đầu bệnh thận mạn ở bệnh nhân đái tháo đường có huyết áp bình thường, tỷ lệ albumin-creatinine trong nước tiểu bình thường (<30 mg/g creatinine) và những bệnh nhân có mức lọc cầu thận ước tính bình thường. A
10. Bệnh nhân nên được bác sĩ chuyên khoa thận đánh giá nếu họ có mức lọc cầu thận ước tính <30 mL/phút/1,73 m2. A
11. Chuyển ngay đến bác sĩ chuyên khoa thận nếu không chắc chắn về nguyên nhân của bệnh thận, các vấn đề quản lý khó khăn và bệnh thận tiến triển nhanh chóng. A
Các từ viết tắt:
- CKD: Chronic Kidney Disease = Bệnh thận mạn
- DKD: Diabetic Kidney Disease = Bệnh thận đái tháo đường
- ESRD: End stage renal disease = Bệnh thận giai đoạn cuối
- UACR: Urinary albumin-to-creatinine ratio = Tỷ lệ Albumin/creatinin niệu
- eGFR: Estimate glomerular filtration rate = Mức lọc cầu thận ước tính
- AKI: Acute kidney injury = Tổn thương thận cấp tính
- ACE: Angiotensin-converting-enzyme = Thuốc ức chế men chuyển đổi
- ARB: Angiotensin II receptor blocker = Thuốc chẹn thụ thể angiotensin II
- MRA: Mineralocorticoid Receptor Antagonist = Thuốc kháng thụ thể Mineralocorticoid
Nguồn: “Chronic Kidney Disease and Risk Management: Standards of Medical Care in Diabetes—2022” Diabetes Care 2022;45(Supplement_1):S175–S184, //doi.org/10.2337/dc22-S011
- 18/03/2023 17:09 - Nhồi máu cơ tim ở bệnh nhân mắc bệnh Hemophilia bẩ…
- 18/03/2023 15:42 - Tiểu không kiểm soát khi gắng sức
- 04/03/2023 10:13 - Cập nhật xử trí xuất huyết tiêu hóa do tăng áp lực…
- 01/03/2023 16:12 - Dị tật bẩm sinh của thận
- 28/02/2023 20:34 - Mê sảng sau ngừng tim
- 11/02/2023 16:18 - Cơ chế thần kinh trong châm cứu giảm đau (p.2)
- 31/01/2023 18:57 - Sàng lọc và dự phòng liên cầu khuẩn nhóm B trong t…
- 30/01/2023 19:08 - Cơ chế thần kinh trong châm cứu giảm đau
- 09/01/2023 14:56 - Giá trị của sFlt-1/ PIGF trong chẩn đoán và tiên đ…
- 04/01/2023 16:00 - MÃN KINH: Triệu chứng- Nguyên nhân- Chẩn đoán- Điề…








