BS. Lê Tự Định - Khoa ICU
Đặt Vấn đề
Liệt mạch là tình trạng sức cản mạch máu hệ thống (SVR = systemic vascular resistance) thấp bất thường được biểu hiện dưới dạng huyết áp thấp rõ rệt hoặc phải cần điều trị để tránh tình trạng huyết áp thấp này, với sự hiện diện của một cung lượng tim bình thường hoặc tăng (Hình 1). Về mặt sinh lý, SVR thấp được định nghĩa là tỷ lệ chênh lệch thấp của áp lực máu động mạch và tĩnh mạch với cung lượng tim [SVR = (MAP - RAP) / CO]. Nguyên nhân của liệt mạch là đa dạng, và một số định nghĩa đã được mô tả cho các nguyên nhân đặc hiệu; tương tự, các thuật ngữ liên quan được sử dụng một cách khác nhau. Việc thiếu vắng sự đồng thuận các định nghĩa dựa trên lâm sàng của chứng liệt mạch đã cản trở tiến trình hiểu biết sinh lý bệnh của chứng này; điều này đặc biệt đúng khi xem xét sự tương đồng giữa sốc giãn mạch do nguyên nhân vô khuẩn hoặc không vô khuẩn — ví dụ hạ huyết áp mặc dù hồi sức dịch đầy đủ trong tổn thương bỏng sớm so với nhiễm khuẩn huyết sớm.
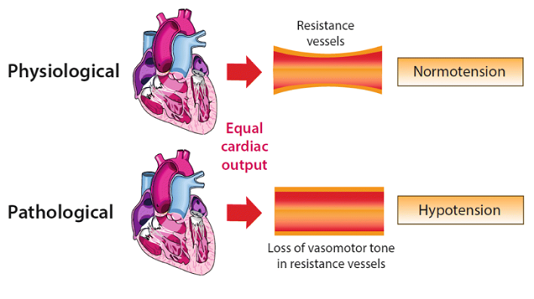
Hình 1: Mối quan hệ giữa trương lực trong sức cản mạch máu, ở tình trạng cung lượng tim tương đương, và huyết áp hệ thống - được giữ nguyên bởi trương lực do tác nhân vận mạch dẫn đến huyết áp bình thường và mất trương lực do tác nhân vận mạch dẫn đến hạ huyết áp
Bệnh nhân điều trị nội trú thường gặp hạ huyết áp do giãn mạch do dùng thuốc gây mê toàn thân hoặc gây tê ngoài màng cứng, và ngay cả khi thoáng qua, điều này có liên quan đến kết cục bất lợi. Tương tự như vậy, hạ huyết áp do giãn mạch do sốc thần kinh có một bệnh sinh không rõ ràng (mất trương lực giao cảm do tổn thương tủy sống) và không được xem xét kỹ thêm. Bài tổng quan này tập trung vào những nguyên nhân của sốc do liệt mạch, phản ánh một đáp ứng khác nhau đối với các mẫu phân tử liên quan đến sinh bệnh học và các mẫu phân tử liên quan đến tổn thương (Hình 2). Đáp ứng với những kích thích này tạo ra sự kết hợp của giãn mạch và gia tăng tính thấm mao mạch. Sự thoát mạch, cùng với sự ứ trệ tuần hoàn qua trung gian của sự liệt mạch có thể dẫn đến tình trạng giảm thể tích máu tuyệt đối, hoặc thường gặp hơn là giảm thể tích máu tương đối. Bù dịch để điều trị hiện tượng này là một tiêu chuẩn chăm sóc, nhưng điều này không điều trị bệnh lý cơ bản và cân bằng dịch dương có liên quan đến sự nguy hại.

Hình 2: Các nguyên nhân lâm sàng chính gây liệt mạch
Sốc do liệt mạch (VS = Vasoplegic shock), đồng nghĩa với sốc do rối loạn phân bố, là một rối loạn tuần hoàn quan trọng đã được mô tả tốt nhất là sự liệt mạch với bằng chứng của tình trạng giảm tưới máu mô có thể đi kèm với tình trạng tăng lactate máu. Sự hiện diện tình trạng tăng lactate máu tiên lượng giai đoạn nghiêm trọng của sự xuất hiện tình trạng sốc hoặc sốc nhiễm khuẩn thực sự. Bài tổng quan này mô tả các cơ chế chính liên quan đến sự phát triển của VS, một quá trình qua trung gian bởi một tập hợp đa dạng các con đường kết hợp và góp phần vào sự tiến triển của tình trạng sốc.
Cho đến nay, các lựa chọn điều trị của chúng tôi bị giới hạn và không nhắm vào một số con đường sinh lý bệnh chính. Điều trị đầu tiên bằng thuốc co mạch là kinh điển với các catecholamin và sự kháng trị có liên quan đến tình trạng hạ huyết áp kháng catecholamine (CRH). Dù việc truyền các thuốc co mạch là cần thiết để duy trì huyết áp động mạch trung bình (MAP) đầy đủ, nhưng sự thay đổi đáng kể vẫn còn trong thực hành lâm sàng, đặc biệt là đối với các mục tiêu được cá nhân hóa tùy thuộc vào các đặc điểm thời kỳ ủ bệnh và nỗ lực nghiên cứu hiện tại đang giải quyết vấn đề này. Hơn nữa, nó cũng được công nhận rằng các catecholamine truyền được kết hợp với một loạt các tác dụng phụ trên chuyển hóa, hệ miễn dịch và đông máu.
Các phương tiện có sẵn cho các bác sĩ lâm sàng để theo dõi mức độ nặng và ảnh hưởng của chứng liệt mạch thị bị hạn chế và các mục tiêu điều trị hiện tại có thể không dẫn đến kết quả ở mức mô mong muốn trên dòng chảy vi mạch. Cải thiện sự hiểu biết về sinh bệnh học của chứng liệt mạch kết hợp với các phương tiện mới để theo dõi tác động của các biện pháp can thiệp vào chức năng của mạch máu có thể dẫn đến sự phát triển các thế hệ kế tiếp các trị liệu hoạt mạch. Đo cung lượng tim, huyết áp hệ thống và áp lực tĩnh mạch trung tâm cho phép tính SVR.
Nguyên nhân gây liệt mạch
Nhiễm khuẩn huyết
Nguyên nhân phổ biến nhất của chứng liệt mạch tại ICU là nhiễm khuẩn huyết. Tỷ lệ này phụ thuộc vào định nghĩa dùng và quần thể bệnh nhân được xem xét. Việc nhận các thuốc co mạch khi thích hợp, hiện nay được công nhận là một đặc điểm chính của sốc nhiễm khuẩn và thực sự định nghĩa gần đây nhất của sốc nhiễm khuẩn không đòi hỏi sự hiện diện của hạ huyết áp dai dẳng. Tuy nhiên, nó bao gồm việc dùng các thuốc co mạch để duy trì huyết áp động mạch trung bình (MAP) là 65 mmHg (trong trường hợp không có giảm thể tích máu) và mức lactat máu cao khi có nhiễm khuẩn huyết. Điều này trái ngược với các định nghĩa trước đó đòi hỏi hạ huyết áp như được phản ánh bởi MAP thấp (<60 mmHg) trong trường hợp không có giảm thể tích máu và nguyên nhân gây hạ huyết áp khác.
Phẫu thuật tim
Liệt mạch và sốc do liệt mạch (VS) xảy ra ở bệnh nhân sau phẫu thuật tim là nguyên nhân phổ biến thứ hai. Chẩn đoán phức tạp hơn vì có nguy cơ xuất hiện giảm cung lượng tim, góp phần gây hạ huyết áp, nguyên nhân phải được phân biệt sớm và chắc chắn giữa giảm tiền gánh do chảy máu, giảm co bóp cơ tim hoặc xảy ra chèn ép tim cấp. Yếu tố phức tạp chính thứ hai là việc sử dụng thường xuyên các thuốc gây giãn mạch có ảnh hưởng trực tiếp đến trương lực mạch máu. Vì vậy, dù không có sự đồng thuận về định nghĩa, có một số định nghĩa được đưa ra i) hạ huyết áp trong trường hợp không có tình trạng cung lượng tim thấp và ii) không có nhiễm khuẩn; các tiêu chuẩn truyền thống cũng có thể có bao gồm sự vắng mặt của các thuốc giãn gây giãn mạch như dobutamine hoặc milrinone, hoặc có bằng chứng của giảm tưới máu mô.
Các yếu tố lâm sàng ảnh hưởng đến sự phát triển của chứng liệt mạch sau phẫu thuật tim đã được mô tả và có nhiều phác đồ điều trị khác nhau, bao gồm cả việc sử dụng các thuốc co mạch thay thế. Mặc dù liệt mạch sau khi phẫu thuật tim thường được quy cho việc bệnh nhân điều trị bằng kỹ thuật tuần hoàn ngoài cơ thể.
Phẫu thuật ngoài tim
Hạ huyết áp do giãn mạch ở bệnh nhân sau phẫu thuật tim lớn thường được biểu hiện như là yêu cầu cho các thuốc co mạch để duy trì MAP đầy đủ sau hồi sức thích hợp để phục hồi thể tích máu bình thường, và tỷ lệ mắc bệnh hiếm khi được báo cáo. Các yếu tố nguy cơ được báo cáo bao gồm phẫu thuật kéo dài và yêu cầu cần phải với truyền máu. Trường hợp hậu phẫu nhập vào ICU là thường quy, việc sử dụng các thuốc co mạch trong giai đoạn hậu phẫu để hỗ trợ huyết áp sau khi tối ưu hóa tình trạng dịch là phổ biến. Dù các thuốc co mạch có thể được yêu cầu để đối lập lại các tác dụng giãn mạch hệ thống của phong bế thần kinh, chẳng hạn như gây tê dưới màng cứng, nơi mà các yêu cầu là đáng kể ở một bệnh nhân đã được hồi sức đầy đủ thì điều này nên được coi là liệt mạch.
Bỏng, chấn thương và viêm tụy
Đây là những tình trạng phối hợp bởi tổn thương mô đáng kể, với sự tăng chuyển hóa, đáp ứng viêm hệ thống và khuynh hướng phát triển rối loạn chức năng nội tạng. Liệt mạch có thể được coi là một rối loạn chức năng cơ quan như vậy, và là một biến chứng được công nhận của đa thương, bỏng và, ngay cả khi không bị nhiễm khuẩn, viêm tụy nặng - nơi chứng liệt mạch có liên quan đến kết cục bất lợi.
Sinh bệnh học chứng liệt mạch
Sinh lý bình thường
SVR được quyết định bởi những thay đổi ở đường kính tiểu động mạch, được kiểm soát bởi hoạt động co bóp của các tế bào cơ trơn mạch máu (VSMC) ở lớp áo giữa. Trạng thái co bóp của VSMC được gọi là trương lực mạch máu và được điều chỉnh thông qua nồng độ canxi (Ca2+) nội bào. Sự co thắt của VSMC được thúc đẩy bởi sự gia tăng nồng độ Ca2+ nội bào thông qua giải phóng Ca2+ dự trữ từ lưới võng mạc cũng như dòng Ca2+ ngoại bào thông qua các kênh nhạy cảm với điện thế. Sự thư giãn của VSMC được điều khiển bởi sự sụt giảm Ca2+ nội bào, do sự hấp thu Ca2+ bởi lưới cơ tương và đẩy kali (K+) hoặc Ca2+ (qua các kênh K+) và bơm Ca2+ - ATPase) vào khoang ngoại bào, dẫn đến tăng phân cực tế bào và gây giãn mạch. Trương lực mạch máu do đó phụ thuộc vào tốc độ đi vào của dòng Ca2+ so với loại bỏ, do đó được điều chỉnh bởi cơ chế nội tại và ngoại tại. Các tác nhân điều hòa bao gồm:
i.Các chất bài tiết của nội mô (nitric oxide, prostacyclin, endothelin)
ii.Các tình trạng chuyển hóa có tính hoạt mạch (nhiễm toan, thiếu oxy, hydrogen peroxide)
iii.Các amin hoạt mạch (serotonin, prostaglandin, thromboxane A2)
Sự điều hòa ngoại tại phần lớn qua trung gian bởi sự kiểm soát thần kinh giao cảm và các hormon hoạt mạch, bao gồm adrenaline, angiotensin II và vasopressin.
Sinh bệnh học của chứng liệt mạch: các yếu tố điều hòa nội tại
Nitric oxide
Nitric oxide (NO), lần đầu tiên được xác định là yếu tố thư giãn có nguồn gốc nội mô (EDRF), là một chất điều hòa quan trọng chức năng mạch máu. NO khuếch tán tự do từ nội mô vào VSMC lân cận và dòng máu gây giãn mạch, ức chế sự tăng sinh VSMC, hoạt hóa tiểu cầu và gây kết dính bạch cầu. Nó được tạo ra từ L-arginine bởi sự tổng hợp nitric oxide nội mô, và ở ít hơn do sự tổng hợp của nơron thần kinh. Những đồng phân cấu thành phụ thuộc canxi này tạo ra NO ở nồng độ ở mức picomolar và điều này gây ra giãn mạch qua trung gian cGMP-PKG.
Các amin hoạt mạch chống viêm, bao gồm bradykinin và thrombin, gia tăng sản lượng NO và gây giãn mạch bằng cách kích hoạt sự tổng hợp NO từ các nơron thần kinh. Ngoài ra, các cytokine gây viêm và PAMPs như lipopolysaccharide (LPS) tạo ra sự tổng hợp các đồng phân của NO. Điều này dẫn đến sự gia tăng NO 2 đến 3 lần so với nồng độ NO cơ sở và là nguyên nhân chính gây rối loạn chức năng mạch máu cấp tính trong sốc. Việc sử dụng các chất ức chế tổng hợp NO không chọn lọc đã được chứng minh là có liên quan đến cải thiện huyết động học ở những bệnh nhân bị sốc nhiễm khuẩn, dù vậy, tỷ lệ tử vong tăng, có thể thông qua tác động ức chế tổng hợp NO lên tế bào miễn dịch và sản xuất NO của tim. Các trị liệu nhắm vào hệ mạch và điều hòa, nhưng không hoàn toàn bãi bỏ, sự gia tăng tổng hợp NO có thể cung cấp một hồ sơ thuận lợi hơn cho những người đã được thử nghiệm trước đây trong các thử nghiệm lâm sàng.
Prostanoids
Prostacyclin (PGI2) được tạo ra bởi nội mô cấu thành và gây ra kết tập tiểu cầu và gây giãn mạch qua trung gian cAMP-PKA . Sản xuất prostacyclin làm tăng đáng kể tình trạng viêm và góp phần gây giãn mạch. Một loạt các yếu tố gây viêm và / hoặc PAMP, bao gồm interleukin 1 (IL-1), yếu tố hoại tử khối u (TNF- α), thiếu oxy và LPS, kích thích sự cảm ứng của COX-2 và tăng tổng hợp PGI2 bằng cách tổng hợp prostacyclin, điều này thúc đẩy tình trạng liệt mạch. Các thử nghiệm điều trị ức chế COX không chọn lọc trong nhiễm khuẩn tỏ ra không thuyết phục, với bất kỳ tác dụng có lợi nào trên mức độ liệt mạch qua trung gian bởi PGI2 có khả năng bù đắp bởi các hoạt động qua trung gian prostaglandin khác.
Một prostainoid có đời sống ngắn, thromboxane A2 (TXA2) đối nghịch các hoạt động của PGI2, thúc đẩy co mạch và kết tập tiểu cầu. Do đó TXA2 đã được xem như là một yếu tố liên quan gây bệnh tiềm tàng trong việc tăng nguy cơ thiếu máu cục bộ tim ở bệnh nhân dùng thuốc ức chế COX2. TXA2 điều chỉnh trương lực mạch máu thông qua việc liên kết với các thụ thể thromboxane-prostanoid (TP) trong cơ trơn mạch máu và, kết hợp với các tác nhân khác, thúc đẩy sự đi vào của dòng canxi và gây co mạch. Các nghiên cứu trên động vật đã gợi ý rằng việc loại bỏ thụ thể TP có liên quan đến việc giảm biểu hiện tổng hợp NO nội tại và bảo vệ chống lại quá trình giảm đáp ứng mạch máu, cho thấy vai trò của TXA2 như là chất điều hòa sự liệt mạch. Ở người, bằng chứng hạn chế cho thấy rằng sự cân bằng giữa TXA2 và PGI2 có thể là quan trọng với mức độ tương đối cao của TXA2 kết hợp với kết cục tồi tệ hơn trong một nghiên cứu sơ bộ của bệnh nhân nhiễm khuẩn huyết.

Hình 3: Sinh bệnh học tình trạng liệt mạch
Endothelin 1
Endothelin 1 (ET1) là đồng phân chiếm ưu thế của họ nội mô và là một peptit nhỏ đóng vai trò như một chất co mạch. ET1 kích hoạt các thụ thể nội mô A (ETA) trong VSMC, một lần nữa làm tăng độ cao Caxi nội bào và gây co mạch. Các phân nhóm của thụ thể nội mô B (ETB), được tìm thấy trong tế bào nội mô và cơ trơn mạch máu, hoạt động như một cơ chế tự điều hòa để kiểm soát trươn lực cơ bản thông qua giãn mạch và co cơ trơn. Tuy nhiên, trong tình trạng viêm do stress, ET1 có tác dụng có hại có thể xảy ra thông qua việc kích hoạt một số đường tín hiệu, tăng tổng hợp IL-1, TNF-a và IL-6. Sự phong tỏa chọn lọc và không chọn lọc của các phân nhóm thụ thể ET đã được chứng minh là có triển vọng trong một loạt các mô hình nghiên cứu trên động vật.
Các gốc oxy tự do
Việc tách các enzyme tổng hợp NO nội mô có thể làm tăng các loại oxy phản ứng và rối loạn chức năng ty thể. Anion superoxide có thể làm giảm NO để tạo thành peroxynitrite (ONOO−), hoạt động như một tác nhân oxy hóa mạnh mẽ gây ra rối loạn chức năng tế bào và gây liệt mạch. Trong tình trạng sinh lý, anion gốc superoxide được chuyển hóa bởi superoxide dismutase (SOD). Các cơ chế không enzyme để chuyển hóa superoxide qua trung gian bằng acid ascorbic và acid uric. Trong tình trạng sốc, kết quả sản xuất NO dư thừa trong quá trình sản xuất NO dư thừa, có thể bị suy yếu bởi chất chống oxy hóa, và các loại oxy phản ứng (ROS) cũng có thể gây ngừng hoạt động của catecholamin.
Hydrogen sulphide
Hydrogen sulphide (H2S) được tổng hợp từ amino acid L-cysteine thông qua vitamin B6 phụ thuộc cystathionine-β-synthase hoặc cystathionine-γ-lyase. H2S dễ dàng khuếch tán vào cơ trơn mạch máu và ở nồng độ thấp có thể có tác dụng bảo vệ tế bào, mặc dù nồng độ của nó trong nhiễm khuẩn huyết tăng đáng kể. Ở nồng độ cao hơn, H2S góp phần vào sự phát triển của sốc giãn mạch thông qua một loạt các hoạt động phụ thuộc oxy, bao gồm ức chế cytochrome oxidase với suy giảm chức năng ty thể, kích hoạt các kênh kali - ATP và ức chế hoạt động enzyme chuyển đổi angiotensin nội mô. Ngoài ra, H2S tương tác với NO, có thể làm giảm tác dụng NO. H2S cũng đã được đề xuất như là một tác nhân điều trị tiềm năng dẫn đến sự phát triển của một trạng thái giống như ngủ đông để bảo vệ tế bào. Động vật được điều trị bằng H2S được bảo vệ khỏi cả tình trạng thiếu oxy gây chết và xuất huyết. Phát hiện này đã dẫn đến nghiên cứu tiền lâm sàng của điều trị H2S trong việc điều hòa các tác động có hại của tổn thương do thiếu máu cục bộ trong các mô hình thí nghiệm, bao gồm tổn thương cơ tim ở lợn.
Tăng phân cực kênh Kali
Như đã chỉ ra, sự chảy tràn kali qua các kênh kali nhạy cảm ATP là một cơ chế quan trọng để điều hòa màng VSMC. Việc kích hoạt quá mức các kênh kali dẫn đến sự tăng phân cực của tế bào, dẫn đến sự bất hoạt của các kênh canxi có cổng điện thế. Sự tuôn ra tiếp theo là một trình điều khiển quan trọng của rối loạn chức năng mạch máu. Ngoài các chất trung gian có nguồn gốc nội mô, một số yếu tố tuần hoàn có thể làm rối loạn chức năng mạch máu qua trung gian kênh kali, bao gồm cả tình trạng thiếu oxy, giảm pH và tăng lactate tuần hoàn. Rối loạn chức năng mạch máu do stress gây viêm như nội độc tố dẫn đến giả thuyết rằng sự ức chế các kênh kali có thể đưa ra một chiến lược điều trị mới. Các mô hình nghiên cứu trên động vật cho thấy sự cải thiện huyết động học sau khi ức chế với thuốc chẹn kênh kali nhạy cảm ATP. Tuy nhiên, các thử nghiệm đối chứng ngẫu nhiên giai đoạn 2 ở các đối tượng con người đã chứng minh không có lợi, và những lo ngại về tác dụng không mạch máu hạn chế tiện ích tiềm năng của nó.
Sinh bệnh học liệt mạch: Điều hòa ngoại tại
Sự đề kháng Catecholamine
Sự phát triển của tình trạng liệt mạch cũng có thể được thúc đẩy bởi những thay đổi về hiệu quả của các catecholamin tuần hoàn trong việc tạo ra sự co thắt của VSMC. Các mô hình nghiên cứu trên động vật cho thấy trong các giai đoạn sau của nhiễm khuẩn huyết, giảm biểu lộ các thụ thể adreno alpha-1 giảm, dẫn đến đề kháng ở ngoại biên với norepinephrine. Trong các nghiên cứu trên người, biểu hiện của các thụ thể ngoại vi dường như có liên quan đến mức độ nặng của bệnh, với biểu hiện tăng nhẹ ở bệnh nhẹ và biểu hiện giảm trong nhiễm khuẩn nặng, cho thấy ở bệnh nhân liệt mạch, một mô hình tương tự như quan sát thấy trong mô hình động vật gặm nhấm có thể xảy ra.
Sự đáp ứng ứng với Corticosteroid
Glucocorticoids làm giảm phản ứng mô đa dạng trong viêm, bao gồm chức năng tuần hoàn của tế bào miễn dịch và giải phóng cytokine. Các quá trình này được điều khiển bởi một số con đường trung gian, bao gồm tổng hợp NO qua trung gian và hoạt tính COX2. Ở mạch máu, các thụ thể steroid có mặt trong cả cơ trơn và mô mạch và trong điều kiện sinh lý, làm tăng đáp ứng với catecholamin và angiotensin II trong tuần hoàn II. Ngoài ra, các hoạt động tế bào nhanh của steroid có thể thúc đẩy tăng nồng độ của các chất truyền tin thứ hai như inositol-3-phosphate và cAMP . Bằng chứng hạn chế cho thấy rằng thiểu năng corticosteroid liên quan đến bệnh nguy kịch có thể phát triển ở trạng thái sốc. Nguyên nhân của sự thiểu năng liên quan tình trạng suy trục HPA, suy thượng thận hoặc hoại tử, và trong một số trường hợp đề kháng ngoại vi với corticosteroi. Những yếu tố này có thể kết hợp để làm trầm trọng thêm rối loạn chức năng mạch máu trong sốc và cung cấp một cơ chế cho lợi ích đề xuất của việc xử trí steroid ngoại sinh để giảm mức độ nghiêm trọng hoặc thời gian phụ thuộc thuốc co mạch trong sốc nhiễm khuẩn.
Vasopressin ngoại sinh
Vasopressin hoạt động thông qua các thụ thể V1 trên bề mặt VSMC để thúc đẩy tăng canxi nội bào thông qua các thụ thể kết hợp protein G và phospholipase C, do đó dẫn đến sự co cơ. Trong sốc nhiễm khuẩn, nồng độ vasopressin huyết tương tăng trong giai đoạn sớm của sốc; tuy nhiên, sau 24 h lại giảm xuống mức bình thường, đó có thể là một cơ chế gây mất trương lực mạch máu. Điều này có thể liên quan đến việc giảm số lượng thụ thể ngoại biên, một hiện tượng được quan sát thấy trong các mô hình nghiên cứu trên động vật. Ngoài ra, các thụ thể V2 trên các tế bào nội mô có thể kích thích sự giãn mạch thông qua gia tăng tổng hợp tăng NO.
Kết luận
Mặc dù liệt mạch là một hiện tượng được công nhận, nó vẫn bị thiếu một định nghĩa lâm sàng thống nhất. Điều này ngăn cản các nhà thử nghiệm lâm sàng và các nhà khoa học dịch thuật chia sẻ ngôn ngữ chung cần thiết để tạo thuận lợi cho nghiên cứu và tăng hiểu biết về hiện tượng này. Chắc chắn, chúng tôi tin rằng một cách tiếp cận thống nhất để mô tả chứng liệt mạch sẽ gặt hái lợi ích và kích thích điều tra thêm về các cơ chế sinh lý bệnh lý cơ bản. Liệt mạch là một hiện tượng phức tạp tập trung xung quanh phản ứng mạch máu với nhiều cơ chế tiềm năng đóng góp (được nêu trong hình 3). Sự ra đời của các chất thay thế khác cho catecholamin, như angiotensin II, có thể báo trước một cách tiếp cận mới để điều trị và tiềm năng cho các phương pháp thay thế. Để biết thêm chi tiết, người đọc được mời tham khảo bài báo điều trị được công bố trong cùng một loạt. Mục tiêu tối ưu cho huyết áp toàn thân vẫn còn gây tranh cãi, và ngày càng thích hợp, các tác nhân dược lý được sử dụng để đạt được những mục tiêu này sẽ được xem xét kỹ lưỡng hơn.
Lượt dịch theo “Definitions and pathophysiology of vasoplegic shock”, Critical Care, June 2018, 22:174
- 24/09/2018 13:34 - Sử dụng clip trong nội soi tiêu hóa
- 24/09/2018 13:03 - Liều thấp atropin cho trẻ ẹm cận thị
- 24/09/2018 12:41 - Phẫu thuật lấy sỏi thận qua da (PCNL :Percutaneous…
- 24/09/2018 08:14 - Tăng tiết mồ hôi tay
- 24/09/2018 07:48 - Cập nhật xử trí ối vỡ non, ối vỡ sớm (ACOG 2018)
- 22/09/2018 21:30 - Dò động mạch cảnh xoang hang
- 22/09/2018 21:00 - Sử dụng steroid dạng hít có thể làm tăng nguy cơ n…
- 22/09/2018 19:48 - Nhân một trường hợp phẫu thuật lấy sỏi bàng quang …
- 22/09/2018 19:42 - Tràn mủ màng phổi
- 22/09/2018 19:31 - Nhân một trường hợp mất da bìu và dương vật








