KTV Võ Thị Thu Nguyệt - Khoa Vi sinh
Để có thu thập, theo dõi, đánh giá và so sánh độ nhạy cảm của vi khuẩn với kháng sinh giữa các vùng trong một quốc gia và giữa các nước trên thế giới, yêu cầu cần phải đặt ra là các kết quả phải xuất phát từ một kỹ thuật chính xác và thống nhất.
Theo báo cáo của các phòng thí nghiệm quốc tế nghiên cứu về phương pháp thử nghiệm độ nhạy cảm của vi khuẩn với kháng sinh và của NCCLS (National Committee for Clinical Laboratory Standars), Tổ chức y tế thế giới đã rút ra nhiều kết luận và đưa ra những chỉ dẫn chung cho các kỹ thuật kháng sinh đồ: đó là kỹ thuật kháng sinh khuếch tán từ đĩa kháng sinh vào môi trường thạch của Kirby – Bauer. Mỗi phòng thí nghiệm, mỗi nước có thể tùy tình hình cụ thể mà cải tiến chút ít để phù hợp với hoàn cảnh sao cho kinh tế và thuận lợi dựa trên phương pháp này.
Ở Việt Nam từ những năm 1989 được sự tài trợ của tổ chức SIDA – Thụy Điển, chương trình ASTS đã thống nhất về kỹ thuật kháng sinh đồ trong toàn quốc. Vì thế để thống nhất kỹ thuật với thế giới và có thể so sánh số liệu thu được với các nước khác, chúng tôi giới thiệu kỹ thuật xác định mức độ kháng thuốc của vi khuẩn theo phương pháp Kirby- Bauer cải tiến: Phương pháp khoanh giấy kháng sinh khuếch tán trong thạch.
I. Mục đích vá các kỹ thuật kháng sinh đồ
Kháng sinh đồ là kỹ thuật đo khả năng của một loại kháng sinh ức chế sự phát triển của vi khuẩn in vitro. Khả năng này có thể được đánh giá bằng phương pháp pha loãng kháng sinh hoặc phương pháp khuếch tán kháng sinh vào môi trường thạch.
1.1. Mục đích
- Nhằm hướng dẫn cho các bác sỹ lâm sàng chọn lựa kháng sinh tốt nhất cho từng bệnh nhân
- Nhằm thu thập những thông tin dịch tễ học về sự đề kháng của vi khuẩn gây bệnh quan trọng ở cộng đồng
1.2. Các kỹ thuật kháng sinh đồ
Kỹ thuật kháng sinh pha loãng trong thạch hoặc canh thang nhằm xác định nồng độ ức chế tối thiểu (MIC) của kháng sinh đối với vi khuẩn (định lượng)
Kỹ thuật kháng sinh khuếch tán trong thạch thường được áp dụng để xác định độ nhạy cảm của vi khuẩn với những kháng sinh khác nhau (định tính). Ở đây kháng sinh thường được thấm trong những khoanh giấy với hàm lượng nhất định.
II. Kỹ thuật kháng sinh khuếch tán trong thạch
Đây là phương pháp đơn giản và có thể tiến hành ở các phòng thí nghiệm hàng ngày không cần nhiều trang thiết bị và máy móc.
2.1. Nguyên lý: Dùng khoanh giấy có đường kính và độ dày nhất định, vô trùng đã tẩm sắn kháng sinh với một nồng độ nhất định ( dựa vào hiệu lực của từng kháng sinh ), đặt lên một đĩa môi trường đã nuôi cấy vi khuẩn. Nồng độ vi khuẩn cũng đã được qui định trước. Để tủ ấm cho vi khuẩn mọc và đo đường kính vòng ức chế vi khuẩn xung quanh khoanh giấy kháng sinh, dựa vào đó xác định mức độ nhạy cảm của vi khuẩn được thử với kháng sinh đó.
2.2. Các yếu tố ảnh hưởng tới kết quả kháng sinh đồ
2.2.1. Môi trường
- Thành phần môi trường:
Môi trường nghèo chất dinh dưỡng sẽ tạo ra vòng ức chế lớn hơn và ngược lại.
- Các chất hữu cơ của môi trường như pepton, cao thịt…làm cho môi trường đủ chất dinh dưỡng nhưng chúng khó đạt tính đồng nhất, ngay cả từ một hãng xuất và ở những lô sản xuất khác nhau.
- Đối với một số vi khuẩn khó mọc môi trường cần cho thêm máu chống đông như máu thỏ, cừu , ngựa…các loại máu khác nhau không ảnh hưởng rõ rệt tới kết quả kháng sinh đồ, trừ máu chống đông bằng Natri citrat đối tetracylin.
- Chủng loại thạch: thạch thô có nhiều phụ chất làm cho vòng ức chế nhỏ lại. Thạch đã tinh chế không có những yếu tố gắn bám kháng sinh sẽ cho kết quả tốt hơn.
- Các Ion trong môi trường như Mg 2+, Ca2+ có ảnh hưởng lớn tới tác dụng của tetracyclin và aminosid . Những ion này có hàm lượng khác nhau trong những lô môi trường khác nhau và mỗi hãng sản xuất khác nhau.
- Độ pH: có ảnh hưởng tới sự phát triển của vi khuẩn và tác dụng của kháng sinh, ví dụ: streptomycin, kanamycin, erythromycin, oleandomycin ở pH = 6 và 6,5 giảm tác dụng so với pH= 7,3 độ pH lại phụ thuộc vào nhiệt độ nên khi điều chỉnh phải lưu ý điểm này.
- Độ dày của thạch: thạch phải có độ dày nhất định vì quá mỏng vùng ức chế sẽ rộng ra và ngược lại. Tốt nhất là dày 4mm.
- Làm khô mặt thạch: làm khô trước khi cấy để vi khuẩn được trãi đều, nếu mặt thạch ướt chúng sẽ mọc thành thảm dày đặc thu hẹp vùng ức chế. Sau khi cấy vi khuẩn nếu để khô quá lâu mới đặt khoanh giấy cũng sẽ làm vùng ức chế nhỏ lại.
2.2.2.Vi khuẩn
- Lượng vi khuẩn cấy vào môi trường có ảnh hưởng lớn tới đường kính vùng ức chế: quá nhiều, đặc vùng ức chế thu nhỏ lại và quá ít, mỏng vùng ức chế mở rộng ra. Tốt nhất là cấy sao cho các khuẩn lạc mọc sát nhau mà không thành thảm.
- Dung dịch vi khuẩn (Inoculum) : là một dung dịch có độ đục nhất định tương ứng 108 vi khuẩn /ml (108 UFC/ml: Colony Forming Unit – đơn vị hình thành khuẩn lạc ), kiểm định bằng độ đục chuẩn Mc Farland 0,5. Độ đục này được pha chế bằng cách lấy 0,5 ml 0,048 M BaCl2 (1,175 % BaCl2.2H2O v/v) cộng với 99,5 ml 0,9 M H2SO4 (1% v/v) , đóng vào các ống nghiệm có độ lớn như nhau, hàn kín và giữ ở nhiệt độ phòng, có thể dùng trong vòng sáu tháng. Trước khi sử dụng phải lắc kỹ.
2.2.3. Khoanh giấy thấm kháng sinh
Mỗi khoanh giấy thấm một lượng kháng sinh nhất định của một loại kháng sinh. Thông thường các kháng sinh cùng họ được thấm lượng như nhau. Mỗi kháng sinh có độ bền vững khác nhau. Nhiệt độ và độ ẩm cao làm bất hoạt kháng sinh nhanh, nhất là họ kháng sinh β-Lactam. Vì vậy việc cất giữ tốt nhất là ở nhiệt độ -200C hoặc ở 40C trong các lọ kín nút, chống ẩm. Có thể mua khoanh giấy thấm kháng sinh của nước ngoài hay tự sản xuất. Nếu tự sản xuất có thể dùng nhiều loại giấy thấm khác nhau. Giấy nhuộm màu có thể ảnh hưởng tới kháng sinh tetracyclin. Khoanh giấy tự sản xuất cần có kiểm tra độ đồng đều và tác dụng đối chứng với khoanh giấy chuẩn thấm kháng sinh tương ứng của nước ngoài.
2.3. Các bước tiến hành
2.3.1. Chuẩn vị môi trường: môi trường được chuẩn bị theo hướng dẫn của từng hãng sản xuất bằng cách cân chính xác lượng thạch Mueller – Hinton khô và hòa tan vào nước cất trung tính, kiểm tra pH trước khi hấp tiệt khuẩn. Trong khi hấp , tránh để môi trường ở nhiệt độ cao và thời gian dài hơn sự cần thiết, vì điều đó sẽ làm giảm khả năng đệm và thay đổi pH của môi trường. Sau khi để nguội môi trường đến 50 – 600C (có pH khoảng 7,2 – 7,4) có thể thêm máu hoặc các sản phẩm của máu…lắc cho đều và đổ vào đĩa petri đã vô khuẩn với độ dày từ 3,5 – 4,5 mm (có nghĩa là là 25 ml thạch cho một đĩa petri đường kính 90 mm hoặc 40ml thạch cho đĩa có đường kính là 110mm). Các đĩa này phải đặt trên một mặt phẳng ngang bằng để đảm bảo cho độ sâu của thạch ở mọi vị trí trong đĩa bằng nhau. Để đĩa môi trường nguội ở nhiệt độ phòng rồi bảo quản trong túi nilon ở tủ lạnh 4-80C. Các đĩa thạch này dùng trong vòng 7 ngày kể từ ngày chuẩn bị.
Các đĩa thạch có máu (hoặc các sản phẩm của máu ) phải được kiểm tra vô khuẩn trong tủ ấm qua đêm mới được sử dụng.
2.3.2. Ria cấy vi khuẩn: Sau khi vi khuẩn thuần khiết được nuôi cấy qua đêm trên các môi trường không có chất ức chế, dùng que cấy lấy 5-10 khuẩn lạc, nghiền trong một ống nước muối sinh lý vô trùng lắc đều bằng máy votex, so sánh với ống đọ đục chuẩn Mc Farland 0,5 (nếu đục quá cho thêm nước muối sinh lý; ngược lại không đủ độ đục cho thêm vi khuẩn), ta được hỗn dịch vi khuẩn tương đương 108 CFU/ml. Dùng que tăm bông vô trùng nhúng vào hỗn dịch vi khuẩn trên ép vào thành ống cho bớt nước, rồi ria đều khắp mặt thạch thành những đường bắt chéo nhau 1200 lên mặt thạch đã được để trong tủ ấm cho khô ( nhưng không được quá 30 phút).
2.3.3. Chuẩn bị khoanh giấy kháng sinh: Lấy ống khoanh giấy kháng sinh từ tủ lạnh để nhiệt độ phòng 30 phút cho thăng bằng nhiệt độ trong và ngoài ống.
Đặt các khoanh giấy đã chọn lựa với từng vi khuẩn đã được thử sao cho mặt của khoanh giấy áp sát vào mặt môi trường, mép ngoài của khoanh giấy cách thành trong của đĩa khoảng 15mm và khoanh nọ cách khoanh kia 20mm Để đĩa thạch ở nhiệt độ phòng khoảng 30 phút cho kháng sinh khuếch tán, rồi để môi trường trong tủ ấm 350C qua đêm. Các đĩa thử nghiệm với các chủng H. influenzae, S. pneumoniae…phải để trong tủ ấm có 5-10% CO2.
2.3.4. Đọc kết quả: Dùng thước chia mm đo đường kính vùng ức chế, dựa vào tiêu chuẩn của từng hãng sản xuất khoanh giấy kháng sinh, so sánh đường kính vòng ức chế đo được với giới hạn đường kính vòng ức chế cho từng loại kháng sinh, ta có mức độ nhạy cảm, trung gian và đề kháng của từng loại vi khuẩn.
Nhạy cảm (Sensitivity) nghĩa là vi khuẩn gây nhiễm khuẩn có thể điều trị được với liều thông thường đã được khuyến cáo.
Trung gian (Intermediate) bao gồm các chủng có đường kính vòng vô khuẩn trong giới hạn ( có nghĩa là MIC của chúng thường đến gần nồng độ đạt được trong máu và tổ chức ). Mức độ trung gian có thể áp dụng được trên lâm sàng khi thuốc có đặc tính tập trung được tại vị trí nhiễm khuẩn ( ví dụ: các β-Lactam và quinolon trong nước tiểu ) hoặc khi thuốc ở liều cao ( thí dụ có thể tăng liều các β-Lactam để vượt qua vấn đề kháng thuốc, vì liều khuyến cáo còn xa giới hạn gây tác dụng phụ )
Đề kháng (Resistan): các chủng vi khuẩn không bị ức chế bởi bất cứ nồng độ nào của thuốc mà cơ thể có thể chấp nhận được.
2.4. Kiểm tra chất lượng
2.4.1. Tiến hành:
Để đảm bảo chính xác kết quả xét nghiệm hằng ngày về độ nhạy cảm của vi khuẩn với kháng sinh, phải kiểm tra thường xuyên bằng những chủng mẫu có độ nhạy cảm không thay đổi với các chất kháng khuẩn, công việc này phải tiến hành song song cùng với các chủng mới phân lập cần xét nghiệm. Trước khi sử dụng lô môi trường mới hoặc khoanh giấy kháng sinh mới cũng phải tiến hành kiểm tra chất lượng bằng các chủng mẫu. Các chủng mẫu dùng để kiểm tra chất lượng là:
- Escherichia coli ATCC 25922
- Staphylococcus aureus ATCC 29213
- Streptococcus faecalis ATCC 29212
- Pseudomonas aeruginosa ATCC 27853
2.4.2.Đánh giá kết quả
Vùng ức chế phải nằm trong các giới hạn đã cho trước.
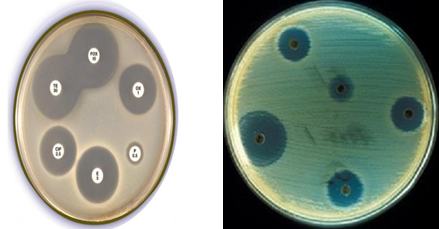
- Một số hình ảnh minh họa kháng sinh đồ trên thạch Mueller-Hinton.
-Hình ảnh minh họa kháng sinh đồ trên thạch máu.

Nguồn: Tài liệu tập huấn chẩn đoán phòng thí nghiệm các bệnh nguyên vi sinh vật gây nhiễm trùng đường hô hấp cấp của trường Đại Học Y Dược Huế ( thuộc dự án trung tâm CARLO URBANI)
- 06/03/2015 19:06 - Một số lưu ý về chế độ ăn uống trong chăm sóc ngườ…
- 05/03/2015 09:29 - Hải Thượng Lãn Ông – Lê Hữu Trác nhà đại danh y dâ…
- 27/02/2015 11:58 - Điều trị kháng sinh hợp lý, an toàn
- 14/02/2015 12:07 - Mối liên quan giữa HIV và hút thuốc lá
- 31/01/2015 21:33 - Viêm gan mạn
- 30/01/2015 17:22 - Phòng ngừa bệnh viêm màng não nhóm huyết thanh B
- 22/01/2015 07:11 - Khái lược về can thiệp động mạch vành qua da (t…
- 20/01/2015 12:19 - Xét nghiệm vật lý nước tiểu
- 13/01/2015 09:34 - Khái lược về can thiệp động mạch vành qua da
- 04/01/2015 15:00 - Ngộ độc trái cây sơn tuế