Bs Trần Quốc Chiến -
DẪN NHẬP
Việc điều trị cho những bệnh nhân ung thư phổi phụ thuộc vào loại tế bào (NSCLC- non small cell lung cancer- UTPKPTBN hay là SCLC- small cell lung cancer-ung thư phổi tế bào nhỏ (UTPTBN)), các đặc điểm phân tử, giai đoạn u, và việc đánh giá tình trạng sức khỏe chung của bệnh nhân.
Bệnh nhân UTPKPTBN giai đoạn I,II, hoặc III thường được điều trị bằng phẫu thuật hoặc xạ trị nhằm mục đích điều trị triệt căn, đôi khi được kết hợp với hóa trị đồng thời hoặc hóa trị bổ trợ. Ngược lại, việc điều trị hệ thống giảm nhẹ thì thích hợp cho những bệnh nhân có tình trạng bệnh ở giai đoạn IV. Điều trị hệ thống giảm nhẹ cũng được sử dụng cho những bệnh nhân tái phát với tình trạng bệnh tiến xa sau điều trị triệt căn ban đầu.

Sự hiểu biết về cơ chế phát sinh UTPKPTBN theo các con đường phân tử được cải thiện đã đưa đến việc phát triển các thuốc điều trị đích theo các con đường phân tử chuyên biệt trong các tế bào ác tính. Khi đó việc điều trị có thể cá thể hóa dựa vào các bất thường chuyên biệt, nếu có, biểu hiện ở một bệnh nhân nhất định.
Việc sử dụng các tác nhân ức chế tyrosine kinase (TKIs- tyrosine kinase inhibitors) thụ thể yếu tố phát triển biểu bì (EGFR)(EGFR TKIs) để điều trị cho các bệnh nhân UTPKPTBN tiến xa có đột biến EGFR sẽ được xem xét lại ở đây. Việc sử dụng các tác nhân này ở những bệnh nhân không có đột biến EGFR (ví dụ, EGFR thể hoang dã) hoặc điều trị duy trì sau hóa trị ban đầu hoặc điều trị nối tiếp khi bệnh tiến triển sẽ được thảo luận ở một bài riêng.
CƠ SỞ LÍ LUẬN
SINH BỆNH HỌC PHÂN TỬ
Sự phát triển và tiến triển của u phụ thuộc vào sự hoạt động của các thụ thể ở bề mặt màng tế bào mà những thụ thể này thì kiểm soát các con đường dẫn truyền tín hiệu vào bên trong tế bào để điều hòa sự tăng sinh, chết theo chu kỳ tế bào, sự sinh mạch, sự kết dính, và tính di động của tế bào.
Các thụ thể bề mặt tế bào này bao gồm các tyrosine kinase thụ thể yếu tố phát triển biểu bì (EGFR, cũng còn được gọi là HER1 hay erbB-1). EGFR tồn tại như là một đơn phân trên bề mặt màng tế bào, và nó phải được nhị trùng hóa để kích hoạt TK. Trong khi sự hoạt động TK của EGFR được kiểm soát chặt chẽ ở các tế bào bình thường, các gen mã hóa các thụ thể này lại có thể trốn thoát được các cơ chế ức chế nội bào thông thường ở các tế ào ác tính.
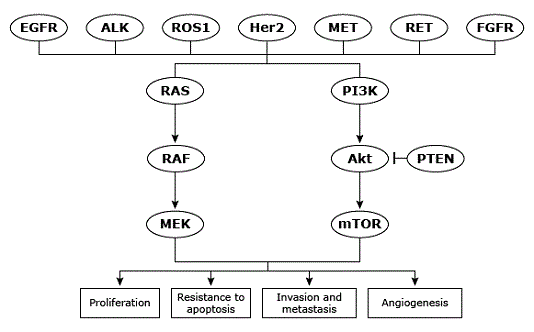
Pathways for molecularly targeted therapy in non-small cell lung cancer.
Original, courtesy of Dr. Joel Neal. Graphic 86507 Version 1.0
ĐỘT BIẾN EGFR LÀ MỘT YẾU TỐ DỰ BÁO CHO SỰ ĐÁP ỨNG
UTPKPTBN tiến xa có các đột biến đặc trưng trên EGFR thì có độ nhạy cao với các EGFR TKI. Việc phân tích có hay không có đột biến EGFR là phương pháp chuẩn để quyết định cho việc có sử dụng hay không sử dụng EGFR TKI để điều trị ban đầu cho bệnh nhân UTPKPTBN tiến xa. Nhiều kỹ thuật xét nghiệm đáng tin cậy là sẵn có để xét nghiệm các đột biến EGFR, và các xét nghiệm này có thể thực hiện được trên mô đã được cố định bằng formalin.
Các đột biến EGFR tyrosine kinase đã được thấy xấp xỉ 15% trong UTPKPTBN biểu mô tuyến ở Hoa Kỳ và tần suất thường gặp hơn ở phụ nữ và ở những người không hút thuốc lá. Ở người Châu Á, tần suất các đột biến EGFR thì cao hơn một cách đáng kể.
Trong nghiên cứu PIONEER, khối u đã được phân tích từ 1482 bệnh nhân ung thư biểu mô tuyến ở bảy vùng lãnh thổ thuộc Châu Ấ (Trung Quốc, Hong Kong, Ấn Độ, Philippines, Đài Loan, Thái Lan, Việt Nam). Tần suất các đột biến EGFR thay đổi từ 22 đến 62%. Mặc dù các đột biến EGFR thì thường gặp hơn ở những người không hút thuốc lá, tần suất này vẫn là 37% ở những người hút thuốc lá. Tần suất nhiều đột biến là cao hơn ở phụ nữ so với nam giới, nhưng sự khác biệt không có ý nghĩa khi xét đến tần suất hút thuốc lá.
Nếu việc điều trị hệ thống là cần thiết trước khi có các kết quả xét nghiệm gen, hóa trị hệ thống được chỉ định. Nếu đột biến EGFR được nhận diện sau khi khởi phát hóa trị, chúng tôi đề nghị hóa trị tiếp tục đến bốn chu kỳ nếu liệu pháp điều trị được dung nạp và không có bằng chứng của bệnh tiến triển. Khi có các kết quả xét nghiệm gen, kế hoạch điều trị sẽ được đánh giá lại. Không có các thử nghiệm lâm sàng nào chỉ dẫn trực tiếp phương thức tiếp cận tối ưu khi đột biến được nhận diện sau khởi phát hóa trị.
CÁC YẾU TỐ KHÁC DỰ BÁO CHO SỰ ĐÁP ỨNG
Các nghiên cứu ban đầu đã cho thấy một vài thông số lâm sàng có liên quan tới tỷ lệ đáp ứng cao với các EGFR TKI và có tiên lượng tương đối tốt. Các thông số này bao gồm mô học là ung thư biểu mô tuyến, giới nữ, không hút thuốc lá, và thuộc chủng tộc Châu Á. Các nghiên cứu tiếp theo đã cho thấy rằng các thông số lâm sàng đại diện cho sự biểu hiện của các đột biến hoạt động chuyên biệt trên miền tyrosine kinase của EGFR (mất đoạn exon 19, đột biến điểm L858R trên exon 21). Tuy nhiên, các thông số lâm sàng không thực sự thay thế được cho xét nghiệm đột biến bởi do nét đặc trưng trên lâm sàng thì không có độ chính xác cao.
HIỆU QUẢ CỦA CÁC EGFR TKI ĐƠN ĐỘC
Các EGFR TKI kéo dài thời gian sống còn bệnh không tiến triển (PFS- progression- free survival) có ý nghĩa ở những bệnh nhân UTPKPTBN tiến xa có đột biến EGFR hoạt động so với hóa trị nền platinum bộ đôi. Tuy nhiên, các tác nhân này ít có hoặc không có ảnh hưởng đến thời gian sống còn toàn bộ (OS- overall survival) trong các thử nghiệm lâm sàng lớn, khả năng là bởi do việc việc sử dụng các tác nhân này như là liệu pháp điều trị bước hai sau khi bệnh tiến triển với hóa trị.
Dữ liệu từ 13 thử nghiệm pha III so sánh EGFR TKI với hóa trị nền platinum được tóm lược trong một phân tích gộp bao gồm 2620 bệnh nhân (1475 đột biến EGFR dương tính và 1145 EGFR âm tính). PFS kéo dài có ý nghĩa (HR 0.43, 95% CI 0.38-0.49), trong khi OS thì không (HR 1.01,95% CI 0.87-1.18).
Mặc dù các TKI EGFR thế hệ một (erlotinib, gefitinib) và thế hệ hai (afatinib) đã được xem như là điều trị chuẩn ban đầu cho EGFR, dữ liệu mới hơn gợi ý các kết quả được cải thiện với điều trị bước một bằng tác nhân thế hệ ba, osimertinib. Dựa vào dữ liệu này, chúng tôi đề nghị osimertinib là sự lựa chọn cho điều trị bước một, mặc dầu các TKI thế hệ một và hai vẫn là lựa chọn để thay thế có thể chấp nhận được. Những lợi ích và những bất lợi của mỗi chiến lược sẽ được thảo luận ở bên dưới.
Phạm vi hoạt động của các TKI EGFR được minh họa bằng các thử nghiệm lâm sàng chính với mỗi tác nhân này.
OSIMERTINIB TRONG BỐI CẢNH ĐIỀU TRỊ BƯỚC MỘT
Mặc dù các TKI thế hệ một đã được xem như là điều trị bước một chuẩn cho UTPKPTBN có đột biến EGFR giai đoạn tiến xa, dữ liệu mới hơn chứng thực các kết quả về PFS được cải thiện với việc điều trị bước một bằng osimertinib so với gefitinib hoặc erlotinib. Dựa vào bằng chứng sẵn có, hiện nay osimertinib là sự lựa chọn thích hợp cho việc điều trị bước một, mặc dù các TKI EGFR thế hệ một và hai vẫn là những lựa chọn thay thế có thể chấp nhận được.
Trong một phân tích tạm thời của thử nghiệm FLAURA pha III, 556 bệnh nhân UTPKPTBN giai đoạn tiến xa có đột biến EGFR, chưa được điều trị trước đó đã được nhận ngẫu nhiên osimertinib so với điều trị chuẩn (SOC- standard of care) bằng EGFR TKI (gefitinib hoặc erlotinib). Các bệnh nhân có di căn hệ thần kinh trung ương với tình trạng bệnh lý thần kinh ổn định được thừa nhận trong nghiên cứu này. Osimertinib đã chứng thực sự cải thiện về PFS (18.9 tháng so với 10.2 tháng; HR 0.46, 95% CI 0.37-0.57) và thời gian đáp ứng (17.2 tháng so với 8.5 tháng) so với SOC. Lợi ích về PFS phù hợp ở các phân nhóm chéo, bao gồm nhóm bệnh nhân có di căn não hoặc không có di căn não. Sự cải thiện về OS có khuynh hướng thiên về không có ý nghĩa thống kê (HR 0.63); tuy nhiên, các kết quả về OS vẫn chưa hoàn thành, với chỉ 25% các sự kiện được thu thập. Các tỷ lệ đáp ứng đối với osimertinib và SOC là 80% và 76%, lần lượt theo thứ tự. Các độc tính độ 3 hoặc cao hơn thì thấp hơn ở nhánh osimertinib so với SOC (34% so với 45%).
Các lợi ích của việc điều trị osimertinib bước một vì vậy bao gồm sự cải thiện về PFS, hiệu quả trong não lớn hơn, khả năng dung nạp tốt hơn, và có điều lợi là có thể đề nghị tác nhân này mà không cần xét nghiệm T790M của khối u. Liên quan đến vấn đề sau này, tất cả bệnh nhân sẽ được tiếp cận với osimertinib, thay vì chỉ một nhóm bệnh nhân có T790M mắc phải như là một cơ chế của sự kháng thuốc. Tuy nhiên, một nhược điểm tiềm ẩn là không có tác nhân điều trị bước hai có hiệu quả cho những bệnh nhân mắc phải đột biến kháng thuốc T790M khi điều trị bước một với TKI thế hệ sớm hơn. Chúng tôi đang chờ đợi dữ liệu về OS để thông tin thêm về cách tiếp cận của chúng tôi.
Cách thức tiếp cận với những bệnh nhân kháng với osimertinib sẽ được thảo luận ở bên dưới.
CÁC TÁC NHÂN THẾ HỆ MỘT VÀ THẾ HỆ HAI
Dữ liệu so sánh gefitinib, erlotinib, và afatinib với hóa trị và mỗi tác nhân khác nhau được thảo luận trong các phần ở bên dưới. Tuy nhiên, dữ liệu sơ bộ gợi ý các kết quả được cải thiện đối với osimertinib, sẽ được thảo luận thêm nữa ở bên dưới.
Erlotinib
Erlotinib đã được so sánh với hóa trị trong một vài thử nghiệm ngẫu nhiên ở những bệnh nhân ung thư phổi có đột biến EGFR, được tóm lược ở bên dưới, tất cả các thử nghiệm này đã chứng thực lợi ích về PFS với erlotinib, nhưng không có lợi ích về OS. Điều này có khả năng phản ánh tác động của các phương pháp điều trị sau thử nghiệm về OS, đặc biệt là cho phép chuyển chéo TKI khi bệnh tiến triển với hóa trị.
Các thử nghiệm erlotinib so với hóa trị được thảo luận ở đây. Một nghiên cứu đã đánh giá erlotinib so với gefitinib và được thảo luận ở bên dưới.
●Thử nghiệm OPTIMAL
154 bệnh nhân đã được nhận ngẫu nhiên erlotinib so với gemcitabine phối hợp với carboplatin. Nhóm điều trị với erlotinib có PFS được cải thiện hơn so với nhóm hóa trị (13.1 tháng so với 4.6 tháng, HR 0.16, 95% CI 0.10-0.26). Tương tự như vậy, tỷ lệ đáp ứng khách quan được cải thiện ở nhóm erlotinib (83% so với 36%). OS ở những bệnh nhân nhận erlotinib so với hóa trị không có sự khác biệt có ý nghĩa thống kê (22.8 tháng so với 27.2 tháng, HR 1.19, 95% CI 0.83-1.71).
●Thử nghiệm EURTAC
174 bệnh nhân đã được nhận ngẫu nhiên erlotinib so với hóa trị nền platinum bộ đôi. PFS tăng lên ở nhóm erlotinib so với nhóm hóa trị (9.7 tháng so với 5.2 tháng, HR 0.37, 95% CI 0.25-0.54). Không có sự khác biệt về OS ở trong nhóm erlotinib và nhóm hóa trị (19.3 tháng so với 19.5 tháng, HR 1.04, 95% CI 0.65-1.68).
●Thử nghiệm ENSURE
275 bệnh nhân được nhận ngẫu nhiên erlotinib hoặc gemcitabine phối hợp với cisplatin. Những bệnh nhân được điều trị với erlotinib có PFS cải thiện hơn so với những bệnh nhân nhận hóa trị (11.0 tháng so với 5.5 tháng, HR 0.34, 95% CI 0.22-0.51). Sống còn toàn bộ trung vị thì tương tự ở cả hai nhóm (26.3 tháng so với 25.5 tháng, HR 0.91, 95% CI 0.63-1.31).
Gefitinib
Trong khi gefitinib đã được chấp thuận trước đó ngoài Hoa Kỳ để điều trị cho bệnh nhân có đột biến EGFR, nó đã được chấp thuận sau đó bởi cơ quan quản lý thuốc và thực phẩm Hoa Kỳ (FDA- Food and Drug Administration) để điều trị cho những bệnh nhân có các khối u đột biến EGFR mất đoạn exon 19 và đột biến hoán đổi exon 21 (L858R). Gefitinib là một sự lựa chọn thích hợp trong bối cảnh này.
Gefitinib đã được so sánh với hóa trị gây độc tế bào như là liệu pháp điều trị ban đầu trong ba thử nghiệm ngẫu nhiên ở những bệnh nhân UTPKPTBN tiến xa có đột biến EGFR hoạt động. Dữ liệu lớn nhất đến từ thử nghiệm IPASS, bao gồm 1217 bệnh nhân được nhận ngẫu nhiên hoặc là gefitinib hoặc là carboplatin kết hợp với paclitaxel. Bệnh nhân được đưa vào thử nghiệm dựa vào các tiêu chuẩn lâm sàng phù hợp với khả năng đáp ứng với gefitinib; tất cả đều là người Châu Á, ung thư biểu mô tuyến và hoặc chưa bao giờ hút thuốc lá hoặc có hút thuốc lá nhẹ trước đó. Toàn bộ, PFS tốt hơn có ý nghĩa trong nhóm gefitinib so với nhóm hóa trị (tỷ lệ sống thêm bệnh không tiến triển 12 tháng là 25% so với 7%, HR dối với bệnh tiến triển là 0.74). Sự khác biệt về OS là không có ý nghĩa thống kê (trung vị 18.8 tháng so với 17.4 tháng, HR đối với tử vong 0.90, 95% CI 0.79-1.02).
Các kết quả phụ thuộc vào tình trạng đột biến EGFR. Các đột biến EGFR biểu hiện 60% ở 437 bệnh nhân có thể đánh giá được; trong số này, 96% có đột biến hoặc là đột biến mất đoạn exon 19 hoặc là đột biến exon 21 L858R.
● Đối với những bệnh nhân có khối u đột biến EGFR, PFS được cải thiện có ý nghĩa ở nhóm gefitinib so với nhóm carboplatin phối hợp với paclitaxel (trung vị 9.5 tháng so với 6.3 tháng, HR đối với bệnh tiến triển là 0.48). OS không tăng lên (trung vị là 22 tháng ở cả 2 nhóm, HR 1.00).
● Đối với những bệnh nhân không có đột biến EGFR, PFS ngắn hơn có ý nghĩa ở nhóm gefitinib (trung vị 1.5 tháng so với 6.5 tháng, HR 2.85 đối với bệnh tiến triển, 95% CI 2.05-3.95). Sự khác biệt về OS không có ý nghĩa thống kê (trung vị 11.2 tháng so với 12.7 tháng, HR đối với tử vong là 1.18).
Thêm hai thử nghiệm pha III cũng đã được hướng dẫn thực hiện dành riêng cho những bệnh nhân có đột biến EGFR (thử nghiệm West Japan Oncology Group 172 và North- East Japan Study Group 002). Toàn bộ các kết quả và độ lớn lợi ích về cơ bản đều giống với thử nghiệm IPASS.
Afatinib
Afatinib là một EGFR TKI không thể đảo ngược, được thấy có hiệu quả lâm sàng trong nhiều thử nghiệm.
Afatinib đã được so sánh với hóa trị như là liệu pháp điều trị ban đầu cho UTPKPTBN tiến xa trong hai thử nghiệm pha III ở những bệnh nhân có các đột biến hoạt động. Hiệu quả của afatinib trong bối cảnh này được minh họa bởi các kết quả của thử nghiệm Lux- Lung 3 pha III, mà trong đó, 345 bệnh nhân chưa được điều trị trước đó đã được nhận ngẫu nhiên với afatinib hoặc với cisplatin và pemetrexed. Điểm cuối chính của thử nghiệm là PFS dựa vào việc đánh giá lại độc lập.
Tại thời điểm theo dõi là 16 tháng, các kết quả chính yếu bao gồm như sau:
●PFS tăng lên có ý nghĩa ở nhóm afatinib so với nhóm hóa trị (trung vị 11 tháng so với 6.9 tháng, tỷ lệ bệnh không tiến triển 12 tháng là 51% so với 21%, HR cho bệnh tiến triển là 0.58, 95% CI 0.43-0.78).
● Tỷ lệ đáp ứng khách quan tăng lên có ý nghĩa ở nhóm afatinib (56% so với 23%). Thời gian đến khi bệnh tiến triển có triệu chứng và chất lượng sống cũng cải thiện có ý nghĩa ở nhóm afatinib.
● Các tác dụng phụ thường gặp nhất là tiêu chảy, ban da, viêm niêm mạc miệng, viêm mé móng, và khô da (95,89,72,57, và 29% các trường hợp, lần lượt theo thứ tự), và các tác dụng phụ này phù hợp với các tác dụng phụ của các EGFR TKI khác.
Thử nghiệm pha III thứ hai đã được hướng dẫn thực hiện trên 364 bệnh nhân Châu Á (Lux- Lung 6), trong thử nghiệm này afatinib đã được so sánh với gemcitabine kết hợp với cisplatin. Các kết quả tương tự cũng được thấy ở nhóm afatinib với PFS tăng lên (11.0 tháng so với 5.6 tháng) và tỷ lệ đáp ứng được cải thiện (67% so với 23%).
Trong một phân tích kết hợp của hai thử nghiệm này (n= 709), trung vị OS tăng lên không có ý nghĩa ở những bệnh nhân nhận afatinib so với hóa trị (trung vị 25.8 tháng so với 24.5 tháng, HR đối với tử vong là 0.91, 95% CI 0.75-1.11). Khi dữ liệu kết hợp được phân tích dựa vào sự biểu hiện đột biến chuyên biệt, lợi ích có ý nghĩa thống kê về OS và PFS đã được thấy ở những bệnh nhân có đột biến mất đoạn exon 19. Có lợi ích có ý nghĩa về PFS, nhưng không có lợi ích về OS ở những bệnh nhân có đột biến L858R.
Dacomitinib
Dacomitinib là một EGFR TKI thế hệ thứ 2 hiện nay không được chấp thuận ở Hoa Kỳ.
Trong một thử nghiệm pha III đa quốc gia, dacomitinib đã được so sánh với gefitinib ở 452 bệnh nhân UTPKPTBN mới được chẩn đoán có đột biến EGFR. Tại thời điểm theo dõi trung vị 22 tháng, PFS tăng lên ở nhóm dacombitinib so với nhóm gefitinib (14.7 tháng so với 9.2 tháng; HR 0.59, 95% CI 0.47-0.74). Tuy nhiên, viêm da độ 3-4 thường gặp hơn ở nhóm dacomitinib (14% so với 0%), cũng như tiêu chảy độ 3-4 (8% so với 1%). Ngoài độc tính của nó, lợi ích tiềm năng của tác nhân này có thể bị hạn chế thêm nữa bởi sự chuyển tiếp đã được dự đoán trước của EGFR TKI thế hệ 3 osimertinib trong bối cảnh điều trị bước một khi đánh thức các kết quả đã được báo cáo của thử nghiệm FLAURA.
So sánh gefitinib, erlotinib, và afatinib
Lựa chọn EGFR TKI thế hệ thứ nhất và thế hệ thứ hai nên được cá nhân hóa theo bệnh nhân và tài liệu tham khảo của nhà cung cấp. Dữ liệu sẵn có gợi ý rằng erlotinib, gefitinib, và afatinib đều có hiệu quả trong ung thư phổi có đột biến EGFR và thường được dung nạp tốt. Một vài dữ liệu gợi ý rằng afatinib có thể có lợi nhất về kết quả điều trị bệnh nhưng cũng gây ra nhiều tác dụng phụ nhất. Một vài bằng chứng gợi ý gefitinib có lẽ được dung nạp tốt nhất trong các tác nhân này, mặc dù điều này đã không được quan sát một cách nhất quán. Osimertinib, như là một sự lựa chọn bước một để thay thế, được thảo luận ở bên dưới.
Trong các thử nghiệm ngẫu nhiên, gefitinib đã được chứng thực hiệu quả có thể so sánh được với erlotinib. Cho ví dụ, trong một nghiên cứu với 561 bệnh nhân UTPKPTBN tiến xa đã được điều trị trước đó với hóa trị, gefitinib và erlotinib được chứng thực tương đương về PFS trung vị (6.5 tháng và 7.5 tháng, lần lượt theo thứ tự; HR 1.125, 95% CI 0.94-1.35) và OS trung vị (22.8 tháng và 24.5 tháng; HR 1.04, 95% CI 0.83-1.29). PFS ở 401 bệnh nhân có các đột biến EGFR là 8.3 tháng (95% CI 7.2 đến 9.7 tháng) đối với những bệnh nhân nhận gefitinib và 10.0 tháng đối với những bệnh nhân nhận erlotinib (95% CI 8.5 đến 11.2 tháng). Trong khi cả hai thuốc đều được dung nạp tốt, tần suất ban da độ 3 thấp hơn ở những bệnh nhân được điều trị với geftinib (2% so với 18% ở những bệnh nhân nhận erlotinib), và tần suất tăng transaminase độ 3 hoặc 4 cao hơn (ALT/AST tăng trong 6.1%/13.0% bệnh nhân nhận gefitinib và 2.2%/3.3% bệnh nhân nhận erlotinib). Nhìn chung, độc tính mức độ nặng ở mỗi bệnh nhân là nặng hơn ở nhóm nhận erlotinib. Tương tự như vậy, một thử nghiệm ngẫu nhiên tiếp theo sau đó ở 256 bệnh nhân cũng đã chứng thực PFS và OS trung vị giữa erlotinib và gefitinib là tương đương nhau. Mặc dù không có sự khác biệt về các độc tính độ 3/4 giữa hai tác nhân trong nghiên cứu này.
Trong một nghiên cứu pha IIB so sánh gefitinib và afatinib, các kết quả bệnh được cải thiện một cách vừa phải với afatinib, mặc dù các độc tính nghiêm trọng cũng thường gặp hơn. Trong số 319 bệnh nhân UTPKPTBN có đột biến EGFR giai đoạn IIIB chưa được điều trị trước đó, PFS đối với afatinib là 11.0 tháng (95% CI 10.6-12.0) và 10.9 tháng đối với gefitinib (95% CI 9.1-11.5). Trong một báo cáo tiếp theo sau đó với thời gian theo dõi dài hơn là 43 tháng, OS trung vị là 27.9 tháng cho afatinib so với 24.5 tháng cho gefitinib (HR 0.86, 95% CI 0.66-1.12). Thời gian đến khi thất bại điều trị là dài hơn cho afatinib (13.7 tháng, 95% CI 11.9- 15.0) so với gefitinib (10.9 tháng, 95% CI 9.1-11.5). Các biến cố bất lợi có liên quan đến điều trị nghiêm trọng ở những bệnh nhân nhận afatinib xảy ra ở 11% bệnh nhân nhận afatinib và 4% bệnh nhân nhận gefitinib.
Đột biến EGFR S768l, L861Q, và G719X
Afatinib được chấp thuận để điều trị bước một cho các bệnh nhân UTPKPTBN có các đột biến EGFR S768l, L861Q, và G719X, ít gặp hơn các đột biến mất đoạn exon 19 và exon 21 L858R. Tuy nhiên, các đột biến hiếm gặp khác không đáp ứng tốt với afatinib và afatinib không phải là liệu pháp điều trị mẫu mực cho tất cả các đột biến EGFR không thường gặp. Trong một phân tích hậu định gộp của ba thử nghiệm mà ở đó afatinib được so sánh với hóa trị nền platinum như là điều trị bước một, 31 bệnh nhân có đáp ứng khách quan được thấy trong số 42 bệnh nhân (74%), và thời gian đáp ứng trung bình là 21 tháng.
Di căn não
Phẫu thuật và/hoặc xạ trị có thể được chỉ định cho những bệnh nhân có di căn não do UTPKPTBN. Ở những bệnh nhân di căn não được chọn lọc với khối u có đột biến EGFR tyrosine kinase hoạt động, việc điều trị với EGFR TKI có thể có hữu ích lâm sàng đối với tổn thương di căn não. Hiệu quả của osimertinib đối với di căn não đã được thảo luận ở trên.
Thời gian điều trị
Việc điều trị với EGFR TKI thường liên tục cho đến khi bệnh tiến triển. Tuy nhiên, một vài bệnh nhân có tình trạng bệnh tiến triển nhanh khi điều trị với EGFR TKI phải ngừng lại sau một thời gian dài điều trị. Điều này đã được hướng dẫn là tiếp tục điều trị với EGFR TKI ở một vài nhóm bệnh nhân có bệnh tiến triển mà có đáp ứng ban đầu với điều trị. Tuy nhiên, khi hóa trị được khởi phát, việc điều trị với EGFR TKI thường phải được ngừng lại.
Thử nghiệm IMPRESS ở 256 bệnh nhân UTPKPTBN có đột biến EGFR hoạt đột đã so sánh hóa trị kết hợp với gefitinib so với hóa trị đơn độc sau khi bệnh tiến triển với gefitinib bước một. Thử nghiệm này đã cho thấy rằng gefitinib kết hợp với hóa trị không làm kéo dài PFS so với hóa trị đơn độc và có liên quan với OS ngắn hơn so với giả dược.
(Còn tiếp)
Nguồn: Tác giả: . Last updated: Jan 18, 2018.
Người dịch: BS TRẦN QUỐC CHIÊN, KHOA UNG BƯỚU BVĐK QUẢNG NAM
- 25/02/2021 15:07 - Siêu âm doppler động mạch thận
- 23/02/2021 11:42 - Đái tháo đường týp 3 và vai trò trong bệnh Alzheim…
- 19/02/2021 10:51 - Điều trị hệ thống ung thư phổi không phải tế bào n…
- 03/02/2021 15:21 - Quản lý tăng đường huyết chu phẫu
- 26/01/2021 19:44 - Chảy máu cam ở phụ nữ mang thai
- 20/01/2021 19:27 - Hướng dẫn quản lý huyết khối tĩnh mạch của Hiệp hộ…
- 17/01/2021 09:43 - Bệnh lý tuyến giáp và thai kỳ (P.2)
- 13/01/2021 21:03 - Cường cận giáp thứ phát ở bệnh nhân bệnh thận mạn
- 07/01/2021 09:57 - Bệnh lý tuyến giáp và thai kỳ
- 31/12/2020 16:45 - Mười loại vi khuẩn kháng kháng sinh nguy hiểm nhất
