Bs Lê Văn Tuấn -
Vào tháng 12 năm 2019, một loại coronavirus mới ở người (HCoV) đã được xác định và được đặt tên là Coronavirus-2 gây hội chứng hô hấp cấp tính nghiêm trọng (SARS-CoV-2), do nó tương tự như Coronavirus gây hội chứng hô hấp cấp tính nghiêm trọng (SARS-CoV).
SARS-CoV-2 gây ra một căn bệnh có tên là bệnh coronavirus 19 (COVID-19), với các triệu chứng chính là ho, mệt mỏi, chán ăn, đau cơ, thiếu máu và tiêu chảy. Mặc dù hầu hết bệnh nhân COVID-19 có các triệu chứng vừa phải và hồi phục nhanh chóng, một số bệnh nhân phát triển hội chứng suy hô hấp cấp COVID 19 (CARDS). Trái ngược với hội chứng suy hô hấp cấp tính (ARDS), CARDS ban đầu được đặc trưng bởi tình trạng giảm oxy máu nghiêm trọng liên quan đến độ đàn hồi tương đối của phổi cho đến khi phát triển các giai đoạn nặng hơn. Bệnh nhân có thể có biểu hiện khá thoải mái về mặt lâm sàng với "giảm oxy máu thầm lặng" trong giai đoạn đầu. Hơn nữa, sự khác biệt giữa các giá trị cận lâm sàng và hình ảnh trình bày không phải là hiếm. CARDS có thể được trình bày thành hai loại phụ: loại H (độ đàn hồi cao tương tự như ARDS thông thường) và loại L (độ đàn hồi thấp) và việc nhận biết chúng dựa trên các đặc điểm chụp CT, có thể là điều tối quan trọng để cung cấp dịch vụ chăm sóc thích hợp. Thông thường, loại L gặp trước loại H, hiếm khi xuất hiện như là dạng chính của viêm phổi SARS-CoV-2 nặng. Sự không phù hợp về thông khí-tưới máu với các vùng không gian chết chủ yếu trên các phần của phổi có thể là một dấu hiệu của CARDS. Một nghiên cứu ủng hộ rằng việc huy động phế nang tốt hơn và oxy hóa nhiều hơn sẽ đạt được với giá trị PEEP cao ngay cả ở phân nhóm L có nguy cơ cao về tổn thương huyết động và phế nang.
Các mối đe dọa vi rút đang nổi lên và tái phát, chẳng hạn như HCoV, đã tiếp tục thách thức các hệ thống y tế công cộng và gánh chịu chi phí kinh tế và xã hội cho cả cá nhân và quốc gia. Coronavirus là những virus RNA không phân đoạn từ lâu đã được coi là mầm bệnh vụn vặt. Tuy nhiên, trong thế kỷ XXI, hai HCoV có khả năng gây bệnh cao - SARS-CoV và coronavirus gây hội chứng hô hấp Trung Đông - có lẽ đã xuất hiện từ các ổ chứa động vật để gây ra dịch bệnh toàn cầu. Do tỷ lệ lưu hành cao và sự phân bố rộng rãi của các coronavirus cũng như các hoạt động giao tiếp giữa người và động vật ngày càng tăng, các coronavirus mới có khả năng xuất hiện định kỳ do hậu quả của việc thường xuyên lây nhiễm giữa các loài và các sự kiện lây lan không thường xuyên. Các hiệu ứng tế bào phổi trực tiếp do vi rút gây ra, vi rút né tránh các phản ứng miễn dịch của vật chủ và các phản ứng viêm bộc phát được cho là đóng vai trò chính trong mức độ nghiêm trọng của bệnh. Tuy nhiên, các nghiên cứu gần đây với những người bị viêm phổi do SARS-CoV-2 nặng cho thấy rằng sự rối loạn điều hòa phản ứng miễn dịch dẫn đến tình trạng viêm nhiễm dẫn đến CARDS và kết quả gây chết người. Trong tổng quan này, chúng tôi muốn thảo luận về những tiến bộ gần đây trong việc hiểu rõ cơ chế bệnh sinh viêm phổi SARS-CoV-2.
1. Liên kết với thụ thể SARS-CoV-2
Enzyme chuyển mạch 2 (ACE2) là một monocarboxypeptidase liên kết màng được tìm thấy phổ biến ở người và biểu hiện chủ yếu ở các tế bào nội mô phổi, tế bào biểu mô phế nang loại II, tim, ruột và thận. ACE2 xúc tác loại bỏ axit amin cuối cùng của angiotensin II (Ang-II), do đó tạo ra peptide giãn mạch, chống xơ hóa, chống tăng sinh và kháng sinh Ang- (1-7), đối trọng với tác dụng Ang-II hoạt động mạch. Các nghiên cứu tập trung vào ACE2 đã cho thấy nhiều vai trò không chỉ xúc tác mà còn là chất vận chuyển axit amin và thụ thể của virus. Như trong bảng 1, các nghiên cứu gần đây đã chứng minh rằng ACE2, là thụ thể xâm nhập chính của SARS-CoV, cũng liên quan đến khả năng gây bệnh của SARS-CoV-2.
Bảng 1 SARS-CoV-2 và liên kết với thụ thể
Mặc dù SARS-CoV-2 có tính tương đồng với các coronavirus được phân lập từ dơi, nhưng cấu trúc miền liên kết thụ thể của nó rất giống với cấu trúc của SARS-CoV. Các tế bào biểu mô đường thở của con người biểu hiện ACE2 được cấy bằng SARS-CoV-2 cho thấy các hiệu ứng tế bào 96 giờ sau khi cấy, bao gồm cả việc thiếu tiêm mao. Sự liên kết chặt chẽ giữa protein đột biến SARS-CoV-2 (S) và ACE2 giải thích một phần sự lây truyền hiệu quả của SARS-CoV-2 ở người. Có bằng chứng cho thấy protein SARS-CoV-2 S liên kết với ACE2 với ái lực cao hơn từ 10 đến 20 lần so với ái lực giữa protein SARS-CoV S và ACE2.
Bản chất của protease tế bào phân cắt glycoprotein S thay đổi tùy theo coronavirus. Có bằng chứng cho thấy SARS-CoV sử dụng serine 2 xuyên màng tế bào để mồi protein S. Gần đây, bằng chứng đã được tìm thấy rằng protein SARS-CoV-2 S cũng sử dụng protease xuyên màng serine 2. Ngoài ra, trình tự protein S của SARS-CoV-2 có mô hình nhận dạng protease giống furin cụ thể hiện diện ở vùng lân cận của một trong những vị trí trưởng thành của protein S không có trong trình tự SARS-CoV. Furin protease là một proprotein convertase chịu trách nhiệm kích hoạt các protein tiền thân, chẳng hạn như các yếu tố tăng trưởng, hormone, các thụ thể và các phân tử bám dính, cũng như các glycoprotein bề mặt tế bào của vi rút lây nhiễm, do đó có khả năng phân cắt các glycoprotein vỏ virus cụ thể, và tăng cường sự dung hợp của virus với màng tế bào vật chủ.
Cuối cùng, phân tử ACE2 hòa tan ở người tái tổ hợp - nhưng không phải ACE2 hòa tan ở chuột - có thể ức chế đáng kể nhiễm trùng SARS-CoV-2 và giảm tải lượng vi rút xuống 1000-5000 bằng cách giảm liên kết protein S của vi rút với ACE2 ở màng. Phát hiện này có thể được sử dụng để nghiên cứu các can thiệp điều trị tiềm năng đối với COVID-19. Ngoài ra, kháng thể đa dòng SARS-CoV ức chế sự xâm nhập của SARS-CoV-2 vào tế bào đích, tạo cơ sở cho việc thiết kế vắc xin (Hình 1 ).
Hình 1

Hội chứng hô hấp cấp tính nặng coronavirus 2 (SARS-CoV-2) liên kết với ái lực cao với enzym chuyển đổi angiotensin 2 ở người (ACE2) và sử dụng nó như một thụ thể xâm nhập để xâm nhập các tế bào đích. Cấu trúc kính hiển vi điện tử lạnh của glycoprotein tăng đột biến SARS-CoV-2 theo hai cấu trúc riêng biệt, cùng với sự ức chế sự xâm nhập qua trung gian tăng đột biến của SARS-CoV (loại coronavirus xuất hiện ở tỉnh Quảng Đông, Trung Quốc vào năm 2002), cung cấp một kế hoạch chi tiết cho việc thiết kế vắc xin và phương pháp điều trị.
2. Bệnh lý phổi và dấu ấn sinh học của tổn thương biểu mô và tế bào nội mô do SARS-CoV-2 gây ra
Một loạt các cuộc khám nghiệm phổi của bệnh nhân COVID-19 trong phòng thí nghiệm đã góp phần làm sáng tỏ bệnh lý miễn dịch đằng sau bệnh viêm phổi SARS-CoV-2 và sự phát triển của bệnh CARDS. Các phát hiện chính được tóm tắt trong Bảng 2 .
Bảng 2 Kết quả khám nghiệm phổi từ bệnh nhân COVID-19

Kiểm tra tổng thể phổi của các bệnh nhân viêm phổi do SARS-CoV-2 cho thấy phù phổi xuất huyết, thường liên quan đến tràn dịch màng phổi và xuất huyết khu trú. Nhiều huyết khối thường có thể nhìn thấy trong lòng mạch phổi (Hình 2 và 3 c). Trên kính hiển vi ánh sáng, viêm tế bào lympho quanh mạch với sự bảo tồn của lòng đường thở xa là đặc điểm mô học chính của viêm phổi SARS-CoV-2 ở giai đoạn sớm và giai đoạn muộn (Hình 3 a – d). Viêm phổi SARS-CoV-2 khác rõ rệt với viêm phổi liên quan đến thở máy do vi khuẩn ở chỗ viêm bạch cầu đa nhân trung tính ở tiểu phế quản bị nhiễm trùng là mô học điển hình. Như được thể hiện trong Hình 3 e – g, tế bào T dương tính với CD8 và CD4 là những tế bào lympho chiếm ưu thế được xác định xung quanh mạch phổi, tiểu phế quản và trong khoảng kẽ. Sự thâm nhiễm thưa thớt của tế bào lympho T dương tính với CD3 có thể được xác định trong vách ngăn phế nang với một vài tế bào lympho B dương tính với CD20. Tổn thương phế nang lan tỏa (DAD), một mô hình không đặc hiệu được quan sát thấy ở ARDS không COVID, cũng là một phát hiện mô học thường xuyên. Trong giai đoạn tiết dịch (cấp tính), DAD được đặc trưng bởi phù mô kẽ, viêm phổi cấp và mãn tính, tăng sản tế bào phổi loại 2, và hình thành màng hyalin (Hình 3 d). Thông khí phổi được duy trì ở giai đoạn đầu của viêm phổi do SARS CoV-2 nặng, giải thích cho việc duy trì sự tuân thủ hô hấp và mô hình siêu âm phổi đặc trưng của các đường B kết tụ khuếch tán (Hình 3 a). Trong giai đoạn tổ chức (chữa lành) được quan sát thấy sau vài ngày trong ICU, các đặc điểm tương tự như của viêm phổi có tổ chức: mô hạt (tích tụ lỏng lẻo của các nguyên bào sợi và myofibroblasts) và viêm mãn tính nhẹ (tế bào lympho và tế bào plasma ) (Quả sung.3 d); những phát hiện này hiếm khi được tìm thấy ở bệnh nhân SARS-CoV-2 vì khám nghiệm phổi thường được thực hiện trước khi bệnh nhân bước vào giai đoạn chữa bệnh.
Hình 2

Hình ảnh tổng thể phổi của hai bệnh nhân tử vong do viêm phổi nặng do SARS-CoV-2 a Phổi bị phù phổi hai bên và các mảng xuất huyết sẫm màu. b và c Các mặt cắt của phổi cho thấy huyết khối hiện diện trong các mạch nhỏ ngoại vi (mũi tên màu xanh lá cây).
Hình 3
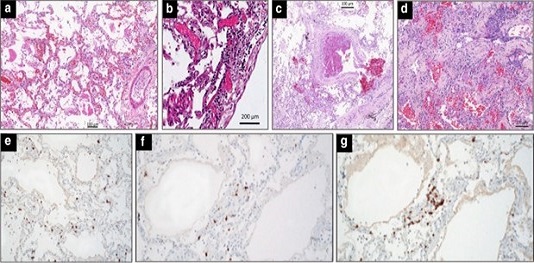
Phát hiện trên kính hiển vi trong phổi của 5 bệnh nhân tử vong do bệnh coronavirus 2019. a Ở một người đàn ông 76 tuổi bị tăng huyết áp chết do ngừng tim 10 ngày sau khi bắt đầu có triệu chứng (không nhập viện ICU), tổn thương phế nang lan tỏa với tắc nghẽn mạch máu, phù nề và thâm nhiễm tế bào lympho quanh mạch; b Ở một người đàn ông 78 tuổi bị tăng huyết áp, bệnh lý béo phì, đái tháo đường týp 2 tử vong do suy hô hấp do thiếu oxy ba ngày sau khi nhập viện và hai ngày thở máy không xâm nhập, viêm phổi kẽ với thâm nhiễm tế bào lympho quanh mạch của vách ngăn giữa phế nang và viêm nội mô đa ổ là quà tặng; NSỞ một người đàn ông 63 tuổi không có bệnh đồng mắc chết do suy hô hấp tim do thiếu oxy 37 ngày sau khi khởi phát các triệu chứng và 26 ngày sau khi nhập viện ICU và thông khí xâm lấn, huyết khối một phần của tiểu động mạch phổi với thâm nhiễm tế bào lympho quanh mạch; d Ở một người đàn ông 64 tuổi không mắc bệnh đồng mắc chết do suy hô hấp tim do thiếu oxy 21 ngày sau khi xuất hiện các triệu chứng và 15 ngày sau khi nhập viện ICU và thông khí xâm lấn, tổn thương phế nang lan tỏa ở giai đoạn tăng sinh xuất hiện với sự lắng đọng các phích cắm collagen trong phế nang. khoảng trống (hematoxylin nhuộm collagen ở các vùng màu hồng nhạt và vùng tế bào); e - gỞ một người đàn ông 77 tuổi bị tăng huyết áp và béo phì nhẹ, tử vong khi nhập viện sáu ngày sau khi xuất hiện các triệu chứng, có biểu hiện viêm phổi kẽ. Tế bào lympho T được đánh dấu bằng các vết nhuộm hóa mô miễn dịch đối với CD3 ( e ), CD4 ( f ) và CD8 ( g ).
Nhiều huyết khối hiện diện trong lòng của các mạch máu phổi xa bao gồm các mao mạch. Những tắc nghẽn mạch máu này thường được quan sát thấy ở ARDS không COVID và không thể được coi là đặc hiệu COVID-19. Liên quan đến huyết khối mạch máu, hình thành mạch sớm và dữ dội được quan sát thấy. So với những bệnh nhân bị viêm phổi nặng do cúm A (H1N1), quá trình hình thành mạch ở bệnh nhân COVID-19 diễn ra sớm và ồ ạt, dẫn đến các đám rối phế nang bị méo mó và hỗn loạn (Hình 4 b), tăng theo thời gian nhập viện (Hình 4 e, f) và xảy ra chủ yếu do lồng ruột (Hình.4 c, e, f). Trong ARDS không COVID, tân mạch quanh co cũng xuất hiện ở pha sớm và pha muộn và cơ chế hình thành mạch vẫn chưa được biết rõ. Cần có các nghiên cứu bổ sung để làm sáng tỏ tác động của hình thành mạch lồng ruột đến kết quả lâm sàng của COVID-19.
Hình 4
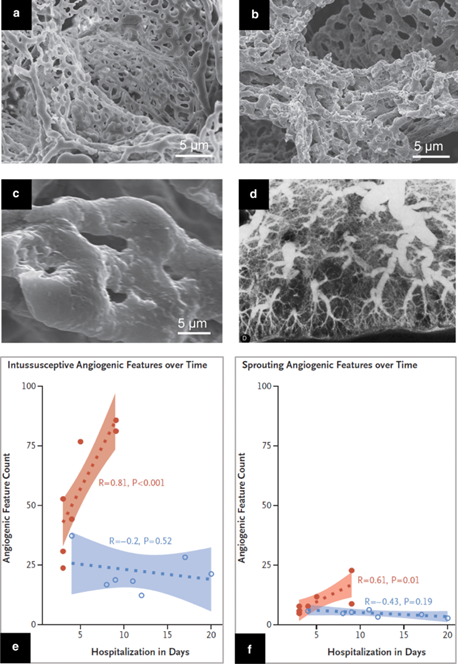
Sự hình thành mạch và neovascularization ở bệnh nhân trầm trọng SARS-CoV 2 viêm phổi a sự dùng kiến hiển vi điện tử cho thấy phôi ăn mòn vi mạch từ đám rối phế nang của phổi khỏe mạnh b Electron sự dùng kiến hiển vi cho thấy phôi ăn mòn vi mạch từ đám rối phế nang của một COVID-19 phổi bị thương với biến dạng kiến trúc đáng kể c Kính hiển vi điện tử cho thấy các vị trí trụ (đầu mũi tên) liên quan đến sự hình thành mạch lồng ruột d Chụp động mạch phổi sau khi chết được thực hiện ở một bệnh nhân tử vong do không dùng COVID ARDS, 26 ngày sau khi chọc hút nhiều. Giường mạch hiếm gặp và quanh co, gợi ý tân mạch bị méo mó ( e và f) So sánh theo trình tự thời gian của quá trình hình thành mạch trong lồng ruột và hình thành mạch ở phổi của bệnh nhân mắc bệnh Covid-19 (màu da cam) và phổi của bệnh nhân cúm A (H1N1) (màu xanh lam) được vẽ biểu đồ như một hàm của thời gian nhập viện. Ở những bệnh nhân COVID 19, sự hình thành mạch do lồng ruột chiếm ưu thế hơn so với sự hình thành mạch đang nảy mầm và tăng lên rõ rệt theo thời gian.
SARS-CoV-2 có thể được quan sát trực tiếp bằng kính hiển vi điện tử hoặc được chứng minh trên các lát mô học bằng phương pháp nhuộm miễn dịch. Cần lưu ý thêm: sử dụng kính hiển vi điện tử, các hạt virus có thể bị nhầm lẫn với các mặt cắt của lưới nội chất thô. Các hạt virut không bị cô lập và tự do trong tế bào chất mà có nhiều hạt bên trong cisternae có màng bao bọc nằm trong vùng Golgi của lưới nội chất thô. Các hạt SARS-CoV-2 được tìm thấy trong các tế bào loại II phế nang với hiệu ứng tế bào virut rõ ràng bao gồm tế bào to và các hạt nhân to với các nucleoli tăng bạch cầu ái toan, sáng, trong các tế bào biểu mô đường thở xa, trong tế bào nội mô phổi và thận [Hình. 5]. Có nhiều lập luận mạnh mẽ cho rằng SARS-CoV-2 chủ yếu lây nhiễm vào các tế bào nội mô. Ngoài sự tích tụ quanh mạch của các tế bào lympho, các tế bào nội mô phổi biểu hiện số lượng thụ thể ACE2 cho sự xâm nhập của virus nhiều gấp đôi so với các tế bào phổi. Tế bào nội mô phổi và thận thường xuyên bị tổn thương về mặt hình thái với sự phá vỡ các điểm nối gian bào, sưng tế bào, co lại lòng mao mạch và mất liên lạc với màng đáy, tất cả các phát hiện đều cho thấy vai trò trung tâm của tế bào nội mô trong giai đoạn mạch máu của COVID-19.
Hình 5
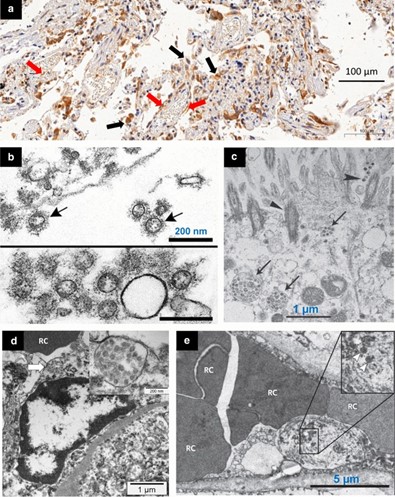
Mô học hiển vi và kính hiển vi điện tử cho thấy SARS-CoV-2 trong phổi và thận của bệnh nhân tử vong do COVID 19. a Ở một người đàn ông 76 tuổi bị tăng huyết áp chết do ngừng tim 10 ngày sau khi xuất hiện các triệu chứng COVID 19 (không nhập viện ICU), nhuộm hóa mô miễn dịch dương tính với SARS-CoV-2 có trong tế bào biểu mô phổi (mũi tên đen) và tế bào nội mô (mũi tên đỏ). Nhuộm miễn dịch được thực hiện bằng cách sử dụng một kháng thể tự sản xuất (Đại học Sao Paulo, Viện Khoa học Y sinh), sử dụng độ pha loãng 1:50, và được phát hiện với hệ thống nhuộm 3,3′-Diaminobenzidine b Không gian phế nang chứa SARS-CoV-2 ngoại bào (mũi tên) với các đường cắt bề mặt nổi bật (dưới cùng: cụm virion) cCác hạt SARS-CoV-2 ngoại bào (mũi tên) hiện diện trong biểu mô đường thở và lông mao (hình tam giác). d Một tế bào nội mô cầu thận đã hoạt hóa có chứa một túi nằm sát biên giới với các hạt giống virus (mũi tên và hình chèn), tiếp giáp với một hồng cầu (RC). e Tế bào nội mô bị tổn thương của mao mạch phổi chứa SARS-CoV-2 (đầu mũi tên). Sưng nhân và tế bào chất làm tắc nghẽn một phần lòng mao mạch.
Nhuộm miễn dịch cho thấy sự biểu hiện nổi bật của protein SARS-CoV-2 Rp3 NP trên tế bào biểu mô phế nang, một bằng chứng khác về sự lây nhiễm trực tiếp bởi SARS-CoV-2. Cuối cùng, các hạt virus SARS-CoV và bộ gen virus đã được phát hiện trong tế bào bạch cầu đơn nhân và tế bào lympho. Tuy nhiên, phát hiện này vẫn chưa được xác nhận trong trường hợp nhiễm SARS-CoV-2. Tổn thương do virus của các tế bào biểu mô và nội mô quan sát được trong CARDS được xác nhận gián tiếp bởi sự gia tăng các dấu ấn sinh học cụ thể. Tăng nồng độ protein surfactant D trong huyết tương, một dấu hiệu sinh học của tổn thương phế nang-phế cầu loại II, có liên quan đến sự phát triển của CARDS và hội chứng kích hoạt đại thực bào ở những bệnh nhân bị bệnh nặng bị viêm phổi SARS-CoV-2 nặng. Mức protein Surfactant D cũng tương quan nghịch với tỷ lệ PaO 2 / FiO 2 ở những bệnh nhân này, cho thấy rằng sự thiếu hụt surfactant do các tế bào phế cầu loại II bị thương có thể góp phần vào sự phát triển của xẹp phổi và giảm oxy máu. Thật không may, dạng hòa tan của thụ thể đối với sản phẩm cuối glycation nâng cao (sRAGE), một dấu ấn sinh học được thiết lập tốt của tổn thương phế nang loại I ở phế nang trong ARDS không COVID, vẫn chưa được báo cáo ở bệnh nhân CARDS. Sẽ rất thú vị nếu so sánh mức sRAGE trong huyết tương và dịch rửa phế quản phế nang ở những bệnh nhân bị bệnh nặng với CARDS và ARDS không COVID và đánh giá xem mức sRAGE có cho phép tách biệt khu trú khỏi kiểu hình CARDS không tiêu điểm và cho phép thở máy cá nhân hay không [ 48]. Mức tăng nồng độ Angiopoietin-2, E-selectin hòa tan và phân tử kết dính gian bào 1 trong huyết tương, tất cả được coi là dấu ấn sinh học của tổn thương nội mô, là dấu hiệu dự báo của CARDS và nhập viện ICU. Điều thú vị là, mức độ Angiopoietin-2 có tương quan nghịch với sự tuân thủ của phổi ở bệnh nhân thở máy. Rất có thể, sự nhiễm virus của các tế bào nội mô gây ra phù phổi loại tính thấm cao và tổn thương phế nang lan tỏa, dẫn đến suy giảm cơ học hô hấp. Tương tự, nồng độ ban đầu cao trong huyết tương của phân tử kết dính gian bào 1 có liên quan đến các dạng viêm phổi SARS-CoV-2 nghiêm trọng, và giảm đáng kể khi hồi phục, cho thấy giảm tổn thương tế bào nội mô.
3. Tế bào lympho và bạch cầu trung tính lưu hành trong bệnh viêm phổi do SARS-CoV-2
Tế bào bạch huyết và bạch cầu trung tính có liên quan đến tổn thương phổi do SARS-CoV-2 gây ra. Giảm bạch cầu xuất hiện ở 83,2% trong số 1099 bệnh nhân mắc COVID-19 khi nhập viện. Hơn nữa, tần suất giảm bạch cầu ở bệnh nhân ICU cao hơn so với bệnh nhân không ICU (85 so với 54%) và là một yếu tố nguy cơ của CARDS. Giảm số lượng tế bào lympho chủ yếu liên quan đến tế bào T CD8, CD4 và CD3.
Bạch cầu trung tính cũng là một phát hiện phổ biến trong COVID-19 nghiêm trọng và được coi là một yếu tố nguy cơ của THẺ và tử vong. Các chức năng kháng khuẩn và viêm của bạch cầu trung tính được thực hiện qua trung gian của một kho chứa protein được lưu trữ trong các hạt và bằng cách hình thành các bẫy ngoại bào của bạch cầu trung tính. Tuy nhiên, bản chất độc hại của những bẫy này có thể gây ra mối đe dọa đối với các mô có tính mạch máu cao như phổi. Một chương trình nội tại tế bào điều chỉnh proteome của bạch cầu trung tính tuần hoàn và giảm khả năng hình thành bẫy ngoại bào của bạch cầu trung tính, bảo vệ phổi chống lại tổn thương viêm do bạch cầu trung tính. Cuối cùng, cũng có bằng chứng về việc tái lập trình miễn dịch bạch cầu trung tính ở bệnh nhân COVID-19 có cơ pyruvate kinase tăng cytosolic, HIF-1α và lactate.
4. Đáp ứng cytokine trong bệnh viêm phổi do SARS-CoV-2 -
Cytokine là một loại rộng các protein nhỏ (<40 kDa) được sản xuất và giải phóng để truyền tín hiệu tế bào và điều hòa miễn dịch. Đáp ứng miễn dịch phối hợp hiệu quả và hiệu quả là tuyến phòng thủ đầu tiên chống lại nhiễm virut, trong khi đáp ứng miễn dịch siêu sinh lý có thể gây tổn thương các cơ quan.
Thuật ngữ '' cơn bão cytokine '' được sử dụng để biểu thị phản ứng viêm quá mức được quan sát thấy trong các trường hợp nhiễm virus nặng. Hội chứng bão Cytokine là một trạng thái quá viêm đặc trưng bởi suy đa cơ quan và tăng nồng độ cytokine. Trong COVID-19, phản ứng miễn dịch được đặc trưng bởi nồng độ cao trong huyết tương của interleukin (IL-6, IL-2), interferon (IFN-y,) chemokine (CXCL10, CCL2, CCL3), yếu tố tăng trưởng (yếu tố kích thích thuộc địa tế bào hạt) và yếu tố hoại tử khối u (TNFα). Một mức độ cao của IL-10 cũng đã được báo cáo; tuy nhiên, mức IL-10 thấp hơn ở những bệnh nhân bị COVID-19 nặng so với những bệnh nhân bị COVID-19 nhẹ. Cấu hình cytokine trong huyết thanh được tóm tắt trong
Bảng 3 Cấu hình cytokine trong bệnh viêm phổi do SARS-CoV-2
IL-6 đóng một vai trò quan trọng trong việc thúc đẩy phản ứng viêm được quan sát thấy trong bệnh viêm phổi nặng do SARS-CoV-2. Mức IL-6 huyết tương ban đầu có tương quan với mức độ nghiêm trọng của viêm phổi và sự mở rộng độ mờ của chụp cắt lớp vi tính (CT). Giảm đáng kể độ mờ IL-6 và CT có liên quan đến sự hồi phục của bệnh nhân, trong khi sự gia tăng IL-6 phụ thuộc vào thời gian dự báo tử vong. Tocilizumab, một kháng thể đơn dòng được nhân bản hóa, được thiết kế đặc biệt để liên kết các thụ thể hòa tan với IL-6, có thể là một lựa chọn điều trị để điều trị CARDS nặng. Tuy nhiên, một thử nghiệm ngẫu nhiên có đối chứng được công bố gần đây không cho thấy bất kỳ sự giảm trầm trọng bệnh, nhập viện ICU và tỷ lệ tử vong. Đáng chú ý, IL-6 không chỉ tham gia vào quá trình hoạt hóa hệ thống miễn dịch mà còn tham gia vào các quá trình tái tạo (đặc tính chống viêm).
Cuối cùng, cấu trúc cytokine ở bệnh nhân COVID-19 giống với hội chứng tăng bạch cầu lympho bào thực quản (HLH) [ 69 ]. Cấu hình cytokine của HLH được đặc trưng bởi mức độ cao của IFN-γ, TNF-α, IL-6, IL-10 và IL-12 [ 70 ], một mô hình tương tự như những gì được tìm thấy trong COVID-19 nghiêm trọng. Các đặc điểm cơ bản khác của HLH như tăng bạch cầu và tăng kali máu cũng là một phát hiện phổ biến trong COVID-19 nặng. HLH là một hội chứng kích hoạt miễn dịch quá mức gây nguy hiểm và đe dọa đến tính mạng. Trạng thái miễn dịch quá viêm / rối loạn điều hòa được cho là do không có sự điều hòa bình thường của các đại thực bào và tế bào lympho đã hoạt hóa gây ra sản xuất quá mức cytokine bởi đại thực bào, tế bào tiêu diệt tự nhiên và tế bào lympho gây độc tế bào.
Một lưu ý về sự thận trọng phải được thêm vào. Sự liên quan của cơn bão cytokine với cơ chế bệnh sinh COVID-19 đã bị chỉ trích. Có bằng chứng cho thấy cấu hình cytokine trong CARDS ít nổi trội hơn khi so sánh với các nhóm bệnh nhân ARDS không COVID trước đó và mức IL-6 trung bình thấp hơn 10 đến 200 lần trong CARDS khi so sánh với kiểu hình siêu viêm của người không COVID ARDS. Do đó, rất có thể “cơn bão cytokine” được quan sát thấy ở các kiểu hình gây viêm cao của CARDS và không phải là đặc điểm của bệnh viêm phổi do SARS-CoV-2.
5. Nguyên nhân có thể gây ra "cơn bão cytokine" ở bệnh nhân COVID-19 nặng
Đáp ứng miễn dịch được thấy ở những bệnh nhân COVID-19 bị bệnh nặng được đặc trưng bởi giảm bạch cầu lympho, bạch cầu trung tính và '' cơn bão cytokine '', những cơ chế này vẫn chưa được hiểu đầy đủ. Cơ chế vật chủ và virus liên quan đến đáp ứng miễn dịch gây ra SARS-CoV-2 được tóm tắt trong Bảng 4 .
Bảng 4 Cơ chế vật chủ và virus của bệnh sinh liên quan đến viêm phổi do SARS-CoV-2

Tương tác đã đề cập trước đây của SARS-CoV-2 với ACE2 có thể là bước chính trong quá trình phát triển phản ứng viêm phổi nặng. ACE2 phân cắt Angiotensin I thành Ang- (1–9) (một peptit không hoạt động) được chuyển thành Ang- (1–7) (một peptit có đặc tính giãn mạch), cân bằng tác dụng của Ang-II. Khi ACE2 được gắn vào bởi protein SARS-CoV-2 S, miền nội bào của nó gây ra sự điều hòa hoạt động của ACE2, thúc đẩy sự chuyển dịch theo con đường xuôi dòng của Ang-II (hoạt hóa trục thụ thể AngII / angiotensin loại 1). Do đó, sự kích hoạt trục thụ thể Ang-II / angiotensin loại 1 dẫn đến sự hoạt hóa qua trung gian glycoprotein 130 của chất dẫn truyền tín hiệu và chất kích hoạt phiên mã 3. Dòng thác này, kết hợp với sự kích thích trực tiếp của các thụ thể nhận dạng mẫu Ang- (1–7) tương tác với thụ thể lắp ráp ty thể (trong cơ trơn phế quản và biểu mô) bắt đầu một dòng chảy nội bào tạo ra sự ức chế p38 p38 kích hoạt protein kinase và các con đường yếu tố hạt nhân-kappa B, cuối cùng dẫn đến giảm mức độ tiền viêm cytokine (như IL-6, TNF-a và IL-8) và giảm biểu hiện của các yếu tố thoát mạch bạch cầu (như phân tử kết dính gian bào-1 và phân tử kết dính tế bào mạch máu-1). Ang- (1–7) cũng điều chỉnh các hoạt động của con đường kinase 1/2 điều hòa tín hiệu ngoại bào, con đường này điều chỉnh việc sản xuất IL-10, làm cho quá trình điều hòa giảm của ACE2 thậm chí còn tồi tệ hơn. Hơn nữa, một chức năng khác của ACE2 là phân cắt cặn tận cùng của [des-Arg9] -bradykinin (BK), một yếu tố gây viêm phổi đã biết. [des-Arg9] -BK là một thành phần của hệ thống kinin-kallikrein, hoạt động thông qua thụ thể BKB1 (BKB1R) và thụ thể bradykinin B2 (BKB2R). Biểu hiện BKB1R được điều chỉnh bởi các cytokine gây viêm (tức là IL-1ß và TNF-α thông qua hoạt động của yếu tố hạt nhân-kappa B) và hiệu ứng hạ lưu của nó thúc đẩy sự di chuyển bạch cầu trung tính đến mô phổi (thông qua chemokine CXC motif chemokine 5), biểu hiện yếu tố tăng trưởng nguyên bào sợi-2, và tăng mức IL-1β và protein hóa học monocyte 1. BKB2R được kích thích bởi bradykinin và dường như không liên quan đến các biến cố chính của bệnh viêm phổi do SARS-CoV-2. Ngược lại, BKB1R như một con đường quan trọng mà qua đó, việc điều hòa ACE2 sẽ dẫn đến viêm [ IL-1ß và TNF-α thông qua hoạt động của yếu tố hạt nhân-kappa B) và tác động xuôi dòng của nó thúc đẩy sự di chuyển của bạch cầu trung tính đến mô phổi (thông qua chemokine CXC motif chemokine 5), biểu hiện yếu tố tăng trưởng nguyên bào sợi-2 và tăng IL-1β và protein hóa học monocyte 1 cấp độ. BKB2R được kích thích bởi bradykinin và dường như không liên quan đến các biến cố chính của bệnh viêm phổi do SARS-CoV-2. Ngược lại, BKB1R như một con đường quan trọng mà qua đó, việc điều hòa ACE2 sẽ dẫn đến viêm [ IL-1ß và TNF-α thông qua hoạt động của yếu tố hạt nhân-kappa B) và tác động xuôi dòng của nó thúc đẩy sự di chuyển của bạch cầu trung tính đến mô phổi (thông qua chemokine CXC motif chemokine 5), biểu hiện yếu tố tăng trưởng nguyên bào sợi-2 và tăng IL-1β và protein hóa học monocyte 1 cấp độ. BKB2R được kích thích bởi bradykinin và dường như không liên quan đến các biến cố chính của bệnh viêm phổi do SARS-CoV-2. Ngược lại, BKB1R như một con đường quan trọng mà qua đó, việc điều hòa ACE2 sẽ dẫn đến viêm.
Giảm bạch huyết, đặc trưng bởi giảm tế bào T CD4 và CD8 ngoại vi, cũng là một đặc điểm nổi bật của COVID-19 nặng. Như đã đề cập ở trên, các hạt virus giống SARS-CoV và RNA SARS-CoV đã được phân lập từ tế bào lympho T ngoại vi. Vì miền liên kết thụ thể của SARS-CoV và SARS-CoV-2 có nhiều điểm giống nhau, nên giả thuyết rằng SARS-CoV-2 có thể lây nhiễm trực tiếp vào tế bào T. là hợp lý. Phát hiện này liên quan đến các cơ chế khác như chết tế bào do tương tác phối tử Fas và Fas và trục phối tử gây apoptosis liên quan đến TNF-α, có thể góp phần vào chứng giảm bạch huyết. Mặc dù có sự giảm số lượng tuyệt đối của tế bào lympho T CD8 và CD4, những tế bào này được tìm thấy ở trạng thái hoạt hóa quá mức, chứa nồng độ cao của các hạt độc tế bào có thể gây ra tổn thương miễn dịch nghiêm trọng. Mặt khác, việc mất tế bào lympho T CD4 có thể gây viêm do suy giảm sản xuất các cytokine chống viêm.
Bạch cầu trung tính và đại thực bào cũng có thể đóng một vai trò trong việc sản xuất quá mức cytokine. Trong trường hợp nhiễm cúm, có bằng chứng cho thấy các tế bào biểu mô phổi, đại thực bào và tế bào đuôi gai đều biểu hiện cytokine thông qua việc kích hoạt các thụ thể nhận dạng mẫu bao gồm các thụ thể giống số điện thoại (3, 7 và 8) gen I cảm ứng axit retinoic và liên kết nucleotide các thành viên gia đình thụ thể giống miền oligomerization. Cần có các nghiên cứu sâu hơn để đánh giá xem liệu các cơ chế như vậy có đóng vai trò gì trong COVID 19 hay không.
Một nguồn khác để kích hoạt phản ứng miễn dịch bẩm sinh là viêm nội mô được chứng minh trong các cuộc khám nghiệm tử thi từ bệnh nhân COVID-19. Có thể như trong trường hợp nhiễm cúm, một khi lớp nội mô mỏng manh bị phá vỡ, sự tiếp xúc với kháng nguyên của cytokine và virus có thể làm tăng phản ứng viêm, với các tế bào nội mô là nguồn chính của cytokine gây viêm. Theo đó, Li et al. Giả thuyết rằng khi sự phá vỡ hàng rào này, bạch cầu đơn nhân và bạch cầu trung tính có thể di chuyển đến vị trí nhiễm trùng để làm sạch dịch tiết phế nang cùng với các phần tử vi rút và tế bào bị nhiễm, dẫn đến một đợt viêm không kiểm soát được.
Cuối cùng, hệ thống bổ thể cũng là một con đường góp phần vào cơn bão cytokine. Sự hoạt hóa virut của bổ thể thường xảy ra thông qua từng một trong ba trục: con đường cổ điển, thay thế và lectin. Một số sản phẩm cuối cùng của những con đường này trực tiếp tăng cường sản xuất cytokine. Aflatoxin C5a có thể tạo ra TNF-α; Phức hợp C5b-C9 kích thích bài tiết IL-6 từ tế bào cơ trơn mạch máu, và C3a hoạt động như một chất kích thích sản xuất IL-1, IL-6 và TNF-α. Dữ liệu gần đây cho thấy SARS-CoV-2 có thể gây ra sự hoạt hóa không bình thường của dòng bổ thể thông qua liên kết protein nucleocapsid của virus với serine protease-2 liên kết với mannose; sự tương tác này thúc đẩy sự hoạt hóa của lectin liên kết mannose, dẫn đến kích thích hạ lưu của dòng bổ thể.
Vạch ra tầm quan trọng của việc kiểm soát cơn bão cytokine, nghiên cứu PHỤC HỒI ngẫu nhiên có đối chứng đa trung tâm đã chứng minh rằng liều dexamethasone hàng ngày 6 mg trong 10 ngày làm giảm tỷ lệ tử vong từ ngày 28 đến 15% ở những bệnh nhân được thở máy do viêm phổi nặng do SARS-CoV-2. Một lợi ích tương tự cũng được tìm thấy trong ARDS không COVID.
5. Khả năng tăng đông liên quan đến COVID-19
Viêm phổi nặng do SARS-CoV-2 có liên quan đến tăng nguy cơ biến cố huyết khối tắc mạch so với dân số thường và bệnh nhân ARDS không dùng COVID-19.
Hầu hết các biến chứng quan sát được là thuyên tắc phổi và tắc mạch khi điều trị thay thế thận liên tục hoặc oxy qua màng ngoài cơ thể. Các biến chứng động mạch như đột quỵ, nhồi máu cơ tim, nhồi máu thận và mạc treo cũng đã được báo cáo. Mức độ cao của các kháng thể chống phospholipid có liên quan đến các sự kiện như vậy. Phân tích trong phòng thí nghiệm luôn cho thấy nồng độ D-dimer và các sản phẩm thoái hóa fibrin/fibrinogen trong huyết thanh cao, với các giá trị thời gian prothrombin tăng nhẹ hoặc bình thường, thời gian thromboplastin một phần được kích hoạt và số lượng tiểu cầu. Nồng độ D-dimer trong huyết thanh> 2 mg / L là dự đoán tử vong ở những bệnh nhân nặng bị viêm phổi do SARS-CoV-2 nặng. Tương đối ít trường hợp đông máu nội mạch lan tỏa đã được báo cáo, cho thấy các cơ chế đặc hiệu gây tăng đông liên quan đến COVID-19 khác với các cơ chế liên quan đến rối loạn đông máu ARDS không COVD.
Ít nhất bốn cơ chế gây bệnh được nghi ngờ: kích hoạt dòng chảy đông máu bởi cơn bão cytokine (với sự tham gia của IL-1, IL-6 và yếu tố mô), suy giảm chức năng của hệ thống tiêu sợi huyết (do tăng giải phóng chất ức chế hoạt hóa plasminogen-1 với sự giảm hoạt động của chất hoạt hóa plasminogen loại urokinase), tổn thương nội mô do viêm và sự hoạt hóa rộng rãi của tiểu cầu bởi các cytokine tiền viêm và sự bộc lộ của nội mạc bị tổn thương.
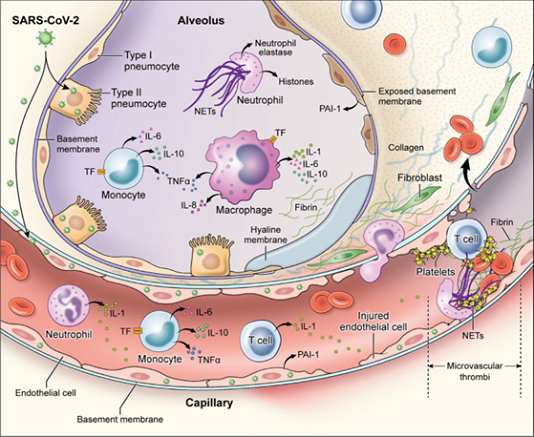
Như trong hình 6, đại thực bào và bạch cầu trung tính đóng vai trò quan trọng trong cơ chế bệnh sinh của huyết khối mao mạch phổi. Mức độ cao của protein viêm đại thực bào, protein hóa học monocyte 1 và protein cảm ứng interferon 10 trong không gian phế nang cũng như sự hiện diện của các bẫy ngoại bào bạch cầu trung tính trong lòng mạch, ngoài lòng mạch và trong phế nang minh họa cho tầm quan trọng của những tế bào này trong sự phát triển của phổi. phát hiện bệnh lý. Hơn nữa, có thể nhiễm SARS-CoV-2 được đặc trưng bởi mối liên hệ trực tiếp giữa tình trạng tăng đông máu và viêm: liên kết thrombin với thụ thể kích hoạt proteinase-1 thúc đẩy quá trình viêm thêm bằng cách tăng nồng độ cytokine. Các mô hình Murine cho thấy giảm viêm sau khi sử dụng thuốc đối kháng thụ thể-1 được kích hoạt proteinase.
Hình 6

Cơ chế rối loạn đông máu ở bệnh nhân viêm phổi do SARS-CoV-2: nhiễm trực tiếp tế bào màng phổi loại II và tế bào nội mô, dẫn đến tăng tính thấm hàng rào; sự hoạt hóa viêm của tế bào T, bạch cầu trung tính, bạch cầu đơn nhân, đại thực bào và tiểu cầu dẫn đến giải phóng cytokine gây viêm, biểu hiện TF và PAI-1 có nguồn gốc từ bạch cầu đơn nhân; sự phát triển của huyết khối vi mạch và đại mạch bao gồm fibrin, NET và tiểu cầu. IL = interleukin; NETs = bẫy ngoại bào của bạch cầu trung tính; PAI-1 = chất ức chế hoạt hóa plasminogen-1; TF = hệ số mô; TNF-α = yếu tố hoại tử khối u-alpha.
Ở những bệnh nhân bị bệnh nặng bị viêm phổi do SARS-CoV-2, việc sử dụng heparin trọng lượng phân tử thấp có thể liên quan đến lợi ích sống còn, có thể do tác dụng chống viêm / chống đông hỗn hợp. Do đó, một số hướng dẫn quan trọng khuyến cáo sử dụng heparin trọng lượng phân tử thấp liều dự phòng hoặc heparin không phân đoạn ở tất cả bệnh nhân COVID-19 cần nhập viện. Các dữ liệu khác khuyến khích việc sử dụng kháng đông điều trị ở những bệnh nhân đáp ứng các tiêu chuẩn về rối loạn đông máu do nhiễm trùng huyết. Tuy nhiên, vẫn cần nghiên cứu thêm để thiết lập các chỉ định, thông số an toàn và hiệu quả của dự phòng huyết khối.
6. Kết luận
Đại dịch COVID-19 buộc cộng đồng khoa học phải đưa ra phản ứng nhanh và một lượng lớn dữ liệu mới đã được công bố kể từ tháng 1 năm 2020. Bài báo này đã xác định các mốc sinh lý bệnh quan trọng của bệnh viêm phổi nặng do SARS-CoV-2. Sự gắn kết của protein SARS-CoV-2 S với ACE2 là cơ chế chính mà vi rút xâm nhập vào các tế bào đích. SARS-CoV-2 lây nhiễm chủ yếu vào tế bào nội mô của mạch máu và mao mạch phổi vì chúng biểu hiện mật độ cao của thụ thể ACE2, tạo ra viêm nội mô phổi thực sự với phù phổi kiểu thấm cao, huyết khối nhiều mạch máu và tân mạch do hình thành mạch nội tạng chiếm ưu thế. COVID-19 là bệnh viêm phổi kẽ đặc trưng bởi phổi tích tụ các tế bào lympho quanh mạch phổi liên quan đến giảm bạch cầu, chiếm ưu thế trên các tế bào T CD4 và CD8. Ở các thể nặng, có một cơn bão cytokine do tương tác của SARS-CoV-2 với ACE2, hoạt động quá mức của tế bào lympho T CD8, mất tế bào lympho T CD4, suy giảm sản xuất cytokine chống viêm và sự hoạt hóa vi rút của bổ thể thông qua nó con đường cổ điển, thay thế và lectin. Cuối cùng nhưng không kém phần quan trọng, viêm phổi nặng do SARS-CoV-2 có liên quan đến tình trạng tăng đông máu toàn thân do tổn thương nội mô do SARS-CoV-2 gây ra, kích hoạt tiểu cầu do tiếp xúc với nội mạc bị tổn thương, kích hoạt dòng chảy đông máu do bão cytokine và suy giảm chức năng của hệ thống tiêu sợi huyết. Các cơ chế chính xác gây ra chứng tăng đông máu do SARS-CoV-2 vẫn chưa được làm sáng tỏ đầy đủ và cần phải nghiên cứu thêm. Chứng minh gần đây rằng dexamethasone làm giảm tỷ lệ tử vong ở những bệnh nhân thở máy bị viêm phổi nặng do SARS-CoV-2 cho thấy tầm quan trọng của việc làm sáng tỏ các cơ chế sinh lý bệnh.
- 08/11/2021 20:01 - Cập nhật khuyến cáo tầm soát ung thư cổ tử cung 20…
- 01/11/2021 17:39 - Chẩn đoán và xử trí huyết khối tĩnh mạch não
- 24/10/2021 09:22 - So sánh các liệu pháp điều trị nội khoa trong lạc …
- 23/10/2021 09:39 - Quan điểm hiện nay về xử trí các biến chứng cơ học…
- 05/10/2021 19:36 - Khuyến cáo của chuyên gia về việc xử trí bệnh nhân…
- 21/09/2021 11:16 - Thay lại dây chằng chéo trước
- 20/09/2021 18:59 - Đồng thuận 2021 của Hội Tim mạch Châu Âu (ESC) về …
- 14/09/2021 21:00 - Bệnh trào ngược dạ dày thực quản trong thai kỳ
- 10/09/2021 16:46 - Xử trí thai chết lưu - thai dị dạng
- 07/09/2021 18:27 - Giảm tiểu cầu huyết khối miễn dịch liên quan đến v…


